Balancing van chemische vergelijkingen
- 2220
- 640
- Lonnie Rohan
Wat is het evenwicht van chemische vergelijkingen?
Het balanceren van chemische vergelijkingen is een wiskundige operatie die wordt uitgevoerd om de wet van behoud van materie in reacties te behouden. Materie wordt niet gecreëerd of vernietigd. Daarom moet het aantal atomen voor en na een chemische reactie hetzelfde zijn, zowel in de reagentia als in de producten.
Om een chemische vergelijking in evenwicht te brengen, moet u de atomen voor en na de pijl tellen. Als de cijfers samenvallen, betekent dit dat de reactie in evenwicht is. Anders is het nodig om deze cijfers te matchen door de stoichiometrische coëfficiënten door vallen en opstaan te wijzigen, dit is de eenvoudigste en meest intuïtieve methode voor balans.
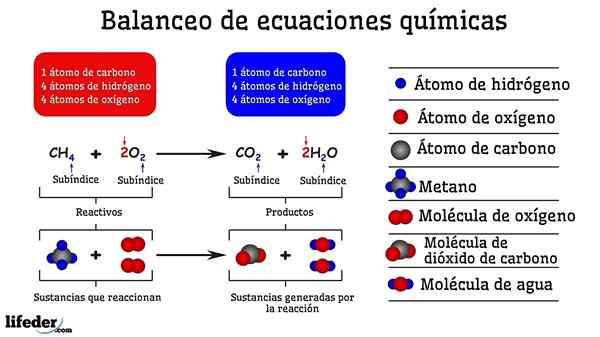
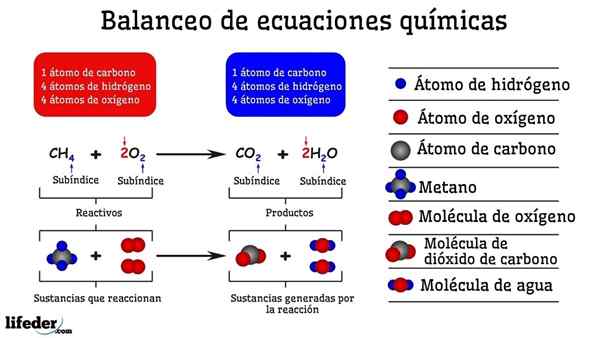 Voorbeeld van chemische balans van de reactie tussen methaan en twee zuurstofmoleculen
Voorbeeld van chemische balans van de reactie tussen methaan en twee zuurstofmoleculen Wanneer het door vallen en opstaan in evenwicht wordt gebracht, is het alsof ze zijn verwijderd of atomen toegevoegd in een van de twee zijden van de Subbaja. Totdat de Subbaja niet horizontaal is opgehangen, zal de chemische vergelijking niet volledig in balans zijn. Er kunnen niet meer (creëren materie) of minder atomen (vernietigen materie) aan alle kanten.
Eenvoudige balansvoorbeelden van vergelijkingen
In de volgende voorbeelden ziet u evenwichtig of gemakkelijk om chemische vergelijkingen in evenwicht te brengen. Allen moeten gemeen hebben dat het aantal atomen, voor elk van de elementen, voor en na de pijl hetzelfde zal zijn zodra de chemische vergelijking in evenwicht is.
Kwikoxidatie
2HG +O2 → Hg2OF2
We hebben twee elementen: Mercurius (HG) en Oxygen (O). We drukken het aantal van hun atomen uit voor (reagentia) en vervolgens (producten) van de pijl:
Hg: 2 (links) - 2 (rechts)
Het kan u van dienst zijn: Molaire fractie: hoe het wordt berekend, voorbeelden, oefeningenO: 2 (links) - 2 (rechts)
De vergelijking is evenwichtig omdat Hg -atomen en of hetzelfde zijn aan beide zijden van de pijl.
Waterstofverbranding
H2 + OF2 → h2OF
We hebben weer twee elementen: waterstof (H) en zuurstof (O). De vorige stap herhalen:
H: 2 - 2
O: 2 - 1
Aan de linkerkant is er meer zuurstof dan in de rechterkant. We moeten daarom een andere juiste zuurstof toevoegen. Om dit te doen, wijzigen we de stoichiometrische coëfficiënten, die de cijfers zijn die bij de formules worden vergezeld en voorafgaan. Als we een 2 voor h plaatsen2Of zal ons geven:
H2 + OF2 → 2H2OF
H: 2 - 4
O: 2 - 2
Zuurstof is in balans. Maar geen hydrogenen. Je moet nu twee hydrogenen toevoegen aan de linkerkant:
2h2 + OF2 → 2H2OF
H: 4 - 4
O: 2 - 2
En de vergelijking is uiteindelijk in evenwicht: hetzelfde aantal H en of voor en na de pijl.
Merk op dat stoichiometrische coëfficiënten (2 voor h2 en 1 voor de O2) Vermenigvuldig de subscripts van de formules. Deze vermenigvuldiging geeft ons het totale aantal atomen voor een specifiek element.
Magnesiumreductie
Mg (nee3))2 + 2li → mg +2lino3
We evalueren atoomnummers voor elk element:
Mg: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
De chemische vergelijking is al in evenwicht en het is niet nodig om deze in evenwicht te brengen.
Opgeloste oefeningen
Voordat u verder gaat met het in evenwicht brengen van een vergelijking, is het altijd nodig om te bevestigen of deze niet langer in balans is. Dat gezegd hebbende, we gaan door met de volgende oefening:
Oefening 1
Evenwichtig of niet?
Vertrouwen2OF3 + H2O → geloof (oh)3
We hebben drie elementen: ijzer (geloof), waterstof en zuurstof. Een suggestie op het moment van balansvergelijkingen is om het atoomaantallen van het minder overvloedige element in de vergelijking te tellen; die meestal anders is dan h en o. Zo tellen we eerst de atomen van het geloof:
Het kan u van dienst zijn: methylsalicylaatGeloof: 2 - 1
Subscript 3 van (OH)3 Vermenigvuldig het geloof niet links. Voor H en O hebben we:
H: 2 - 3
O: 4 - 3
Alle elementen zijn onevenwichtig.
Slingeren
Voordat we zelfs H en O in evenwicht brengen, moeten we de atomen van het geloof in evenwicht brengen: het minst overvloedige element, omdat er nauwelijks 3 geloof is, in tegenstelling tot 5 uur en 7 of 7 of 7. Je moet dan een geloof aan de rechterkant toevoegen:
Geloof: 2 - 2
Wat is gelijk aan een 2 als stoichiometrische coëfficiënt voor het geloof (oh)3. De vergelijking blijft:
Vertrouwen2OF3 + H2O → 2fe (oh)3
Geloof: 2 - 2
H: 2 - 6
O: 4 - 6
Maar de H en O of blijven onevenwichtig. Een h2Of draag 2 uur bij en we missen 4 uur. Daarom zullen we nog twee h toevoegen2Of voor ons om drie H te hebben2OF:
Vertrouwen2OF3 + 3H2O → 2fe (oh)3
En we evalueren opnieuw:
Geloof: 2 - 2
H: 6 - 6
O: 6 - 6
Merk op hoe ze ze in evenwicht waren zodra we ooit de h in evenwicht brachten. De vergelijking is eindelijk in balans.
Oefening 2
Evenwichtig of niet?
Ch4 + OF2 → CO2 + H2OF
We evalueren het aantal atomen voor alle huidige elementen:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Koolstof is evenwichtig, maar hetzelfde gebeurt niet met waterstof en zuurstof. De vergelijking is onevenwichtig.
Slingeren
Omdat de C in evenwicht is, willen we de stoichiometrische coëfficiënten van CH niet aanpassen4 of co2. Tenminste niet in principe.
We richten onze aandacht op H en O, vooral op H. Omdat? Omdat het zien van de vergelijking, is het gemakkelijker om h vóór of. We moeten 2 uur aan de rechterkant toevoegen en een coëfficiënt 2 plaatsen voor h2OF:
Ch4 + OF2 → CO2 + 2h2OF
C: 1 - 1
H: 4 - 4
O: 2 - 4
C en H zijn evenwichtig. We blijven 2 of links. Als elk of2 draagt 2 of, we zullen een of toevoegen2 extra zodat ze 4 of links zijn. Dit is hetzelfde als het plaatsen van een coëfficiënt 2 voor de O2:
Kan u van dienst zijn: zwaveloxideCh4 + 22 → CO2 + 2h2OF
C: 1 - 1
H: 4 - 4
O: 4 - 4
En de vergelijking is eindelijk in balans.
Oefening 3
Evenwichtig of niet?
N2 + H2 → NH3
We evalueren voor onze twee elementen N en H:
N: 2 - 1
H: 2 - 3
De vergelijking is niet in balans.
Slingeren
We beginnen de n, het element anders in evenwicht te brengen. We missen een recht, en zoals elke NH3 draagt 1 N bij, we moeten nog een NH toevoegen3 Om 2 n te hebben:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
En nu missen we links. Als elke h2 Draag 2 uur bij aan de vergelijking, dan moeten we er nog twee toevoegen zodat er 6 uur zijn. Dit is hetzelfde als het plaatsen van een stoichiometrische coëfficiënt 3 voor h2:
N2 + 3H2 → 2nh3
N: 2 - 2
H: 6 - 6
En de chemische vergelijking is eindelijk in balans.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Chemistry Libhethexts. (23 november 2020). Hoe u uitgebalanceerde chemische vergelijkingen schrijft. Hersteld van: chem.Librhetxts.borg
- Wikipedia. (2020). Reactievergelijking. Opgehaald uit: in.Wikipedia.borg
- Principes van chemie. (S.F.)). Schrijven en in evenwicht brengen van chemische vergelijkingen. [PDF]. Opgehaald uit: Web.Ung.Edu
- Phet. (S.F.)). Balancing van chemische vergelijkingen. Hersteld van: phet.Colorado.Edu
- Armando Marín B. (S.F.)). Algemene chemie: balancering van vergelijkingen. [PDF]. Hersteld van: depa.Fquim.UNAM.mx

