Cadmium (CD) geschiedenis, eigenschappen, structuur, gebruik

- 4489
- 1206
- Dewey Powlowski
Hij cadmium (CD) is een overgangs- of post -transitionaal metaal van atoomnummer 48 en zilveren kleur. Het is kneedbaar en ductiel, met relatief lage smelt- en kookpunten. Cadmium is een zeldzaam element en heeft nauwelijks een concentratie van 0,2 g / ton van de aardkorst.
La Greenockita (CDS) is de enige belangrijke MENA van het cadmium die een intense gele kleur heeft. Het cadmium wordt geassocieerd met zink in het sphaleriet (ZnS), dat tussen 0,1 en 03 % cadmium bevat als een CD -kation2+.
 Cadmiumkristallen. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Cadmiumkristallen. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Bij het verwerken van het sphannel voor het verkrijgen, gieterij en raffinage van zink, wordt cadmium secundair verkregen, dit is de belangrijkste productiebron.
Dit metaal werd ontdekt in 1817, onafhankelijk van Friedrich Stromayer en Karl Hermann. Stromayer doopte het nieuwe element met de naam van cadmium, afkomstig van het Latijnse woord "cadmia", een term als calamine (zinkcarbonaat) was bekend (zinkcarbonaat).
 Cadmium is een chemisch element met het CD -symbool en het atoomnummer is 48. Bron: albedo-UKR CC BY-SA 2.5 (http: // creativeCommons.Org/licenties/by-sa/2.5/)
Cadmium is een chemisch element met het CD -symbool en het atoomnummer is 48. Bron: albedo-UKR CC BY-SA 2.5 (http: // creativeCommons.Org/licenties/by-sa/2.5/) Cadmium is een element van groot nut en talloze toepassingen, zoals anticorrosief ijzer-, staal- en niet -ferrometalen; gebruik als pigment; PVC -stabilisatie; element in legeringen die in lassen worden gebruikt; Nikkel-cadmiumbatterijen oplaadbaar, etc.
Het is echter een zeer giftig element dat ernstige schade aan de longen, nieren en botten veroorzaakt, en zelfs een carcinogene actie is aangegeven, en daarom is het gebruik ervan beperkt geweest. Maar ondanks dit is het nog steeds zorgvuldig gebruikt in sommige toepassingen.
[TOC]
Geschiedenis
- Dubbele ontdekking
Het cadmium werd ontdekt door Friedrich Stromayer, een Duitse chemicus, in 1817 in een zinkcarbonaatmonster (calamina). Datzelfde jaar, k. S. L. Hermann en J. C. H. Roloff deed dezelfde ontdekking, onafhankelijk, in een experiment uitgevoerd met zinksulfide.
Er is op gewezen dat Stromayer zijn ontdekking deed tijdens de vervulling van een regeringsaanvraag om de apotheken van de stad Hildesheim, Duitsland te inspecteren. Zinkoxide werd, zoals nu, gebruikt bij de behandeling van bepaalde huidaandoeningen.
Het lijkt erop dat apotheken geen zinkoxide hebben uitgegeven, maar in plaats daarvan zinkcarbonaat verkocht: grondstof voor zinkoxide -productie. Zinkoxide -fabrikanten voerden aan dat het zinkcarbonaat een geel "zinkoxide" werd verwarmd.
Cadmiumoxide
Ze konden dit "zinkoxide" niet verkopen, omdat de kleur van de verbinding normaal gesproken wit was; En in plaats daarvan verkochten ze zinkcarbonaat, ook wit. Gezien deze situatie besloot Stromayer het vermeende gele zinkoxide te bestuderen.
Om dit te doen, verwarmde hij monsters van zinkcarbonaat (calamine) en er was een geel zinkoxide, zoals geïnformeerd. Na het analyseren, concludeerde hij dat de gele kleur een product was vanwege de aanwezigheid van een metalen oxide van een nieuw element.
Na het extraheren van dit nieuwe metalen oxide produceerde het zijn reductie, waarbij het cadmium isolatie bereikte. Stromayer bepaalde zijn dichtheid en verkreeg een waarde van 8,75 g/cm3, Dicht bij de waarde die momenteel bekend is om deze parameter (8,65 g/cm3)).
Evenzo wees Stromayer erop dat het nieuwe element een uiterlijk had dat vergelijkbaar was met platina, en dat het ook aanwezig was in veel zinkverbindingen, en inclusief in het gezuiverde zink.
Stromayer stelde de naam "Cadmium" voor uit de Latijnse stem "Cadmia", naam die de calamina werd genoemd, Znco3.
Cadmium in zinksulfide
Karl Hermann (1817) vond een onterechte gele kleur toen hij zinksulfide verwerkte en dacht dat het een verontreiniging met arseen kon zijn. Maar toen deze mogelijkheid was weggegooid, besefte Hermann dat hij in aanwezigheid van een nieuw element was.
- Toepassingen
1840-1940
In de jaren 1840 begon het gebruik van cadmium te worden uitgebuit als een pigment. De Britse farmaceutische codex geeft in 1907 het gebruik van cadmiumjodide aan als medicijn om "vergrote gewrichten", scrofulous klieren en sabañones te behandelen.
In de jaren dertig en 1940 was de cadmiumproductie bestemd voor het platina van staal en ijzer om ze tegen corrosie te beschermen. In de jaren 1950 werden cadmiumverbindingen gebruikt, zoals cadmiumsulfide en cadmium selenide als bronnen van rode, oranje en gele pigmenten.
1970-1990
In de jaren zeventig en tachtig werd ontdekt dat de cadmiumcadmium en stearate -verbindingen PVC -stabilisatoren waren, wat een toename van de cadmiumvraag veroorzaakte. Milieuvoorschriften vanwege de toxiciteit van cadmium.
In de jaren tachtig en negentig stopte het cadmium met het gebruik van veel van zijn toepassingen, maar toen nam de productie toe met het creëren van de oplaadbare batterijen van nikkel-cadmium, die 80 % van het verbruik van cadmium in de Verenigde Staten vertegenwoordigde.
Kan u van dienst zijn: gebruik en toepassingen van alceansFysische en chemische eigenschappen van cadmium
Verschijning
Silleerd en zacht grijs -gray wit. Het wordt bros door blootstelling aan 80 ºC, kunnen met een mes snijden. Is kneedbaar en rollen kunnen met hem worden gevormd.
Standaard atoomgewicht
112,414 u
Atoomnummer (z)
48
Elementcategorie
Post -transition metaal, afwisselend beschouwd als een overgangsmetaal. De definitie van de IUPAC van een overgangsmetaal is er een waarvan de atomen een onvolledige subcap hebben of die kan leiden tot kationen met een onvolledige subcap.
Volgens die definitie is cadmium geen overgangsmetaal sinds zijn cd -kation2+ Het heeft zijn 4D -orbitalen volledig vol met elektronen (4D10)).
Geur
Toilet
Smeltpunt
321.07 ºC
Kookpunt
767 ºC
Dikte
Omgevingstemperatuur: 8,65 g/cm3
Op het smeltpunt (vloeistof): 7.996 g/cm3
Fusiewarmte
6.21 kJ/mol
Verdampingswarmte
99,87 kJ/mol
Molaire caloriecapaciteit
26.020 J/(mol · k)
Elektronegativiteit
1.6 Op de Pauling -schaal
Ionisatie -energieën
Eerst: 867,8 kJ/mol (cd+ gasvormig)
Tweede: 1631.4 kJ/mol (cd2+ gasvormig)
Derde: 3616 kJ/mol (cd3+ gasvormig)
Warmtegeleiding
96.6 w/(m · k)
Weerstand Elektrisch
72,7 nω · m bij 22 ° C
Hardheid
2.0 op de mohs -schaal. Het is een metaal, hoewel dicht, aanzienlijk zacht.
Stabiliteit
Het wordt langzaam geoxideerd door natte lucht om cadmiumoxide te vormen, dat zijn metalen helderheid aantast. Het is niet ontvlambaar, maar in de vorm van stof kan het verbranden en zelf -ontsteking ervaren.
Zelfstudie
250 ºC voor cadmium is een stofvorm.
Brekingsindex
1.8 tot 20 ºC
Reactiviteit
Cadmium kan in de lucht branden om cadmiumoxide (Cao) te vormen, een bruin amorf stof, terwijl de kristallijne vorm donker rood is.
Cadmium reageert snel met verdund salpeterzuur en langzaam met heet zoutzuurzuur. Hij is ook in staat om te reageren met zwavelzuur, maar reageert niet met alkalis. In al deze reacties worden cadmiumzouten van hun overeenkomstige anionen gevormd (CL-) of oxoanions (nee3- En dus42-)).
Elektronische structuur en configuratie
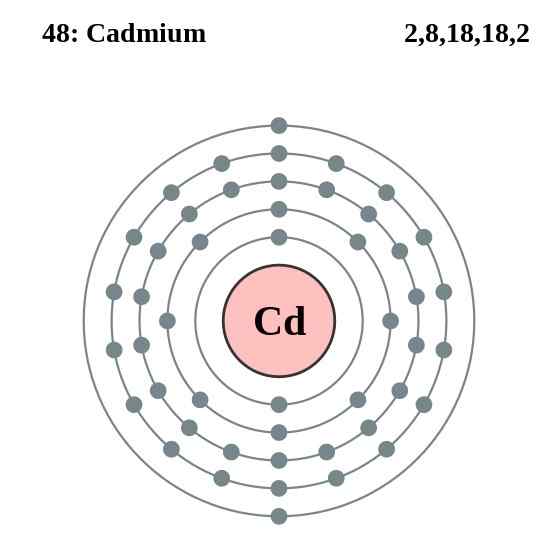 Cadmium elektronenlaagdiagram, element 48 in de periodiek systeemtabel. Bron: Pumbaa (origineel werk van Greg Robson) CC BY-SA 2.0 (http: // creativeCommons.Org/licenties/by-sa/2.0/)
Cadmium elektronenlaagdiagram, element 48 in de periodiek systeemtabel. Bron: Pumbaa (origineel werk van Greg Robson) CC BY-SA 2.0 (http: // creativeCommons.Org/licenties/by-sa/2.0/) De cadmiumatomen van hun glas vestigen een metalen binding van hun valentie -elektronen, die zich in de 4D- en 5S -orbitalen bevinden volgens hun elektronische configuratie:
[KR] 4D10 5s2
Hoewel de 4D -orbitalen vol met elektronen zijn, en dat ook kan worden gedacht dat de "zee van elektronen" overvloedig is om de CD -atomen sterk samen te voegen, zijn de interacties in werkelijkheid zwak. Dit kan experimenteel worden aangetoond met het lage smeltpunt (321 ºC), vergeleken met dat van andere overgangsmetalen.
Daarom, en andere chemische redenen, wordt cadmium soms niet als een overgangsmetaal beschouwd. Er zijn zoveel elektronen (twaalf) betrokken bij hun metaalbinding, die hun negatieve afstotingen beginnen te verstoren; die, samen met het energieverschil tussen de 4D-orbitalen vol en de 5s, de CD-CD-interactie verzwakt.
CD -atomen definiëren uiteindelijk een compacte hexagonale kristallijne structuur (HCP), die geen fase -overgangen lijdt vóór het smeltpunt. Wanneer cadmium HCP -kristallen een druk equivalent aan 10 GPa ondergaan, is de structuur slechts vervormen; Maar zonder een faseverandering te melden.
Oxidatienummers
Cadmium kan de twaalf elektronen van Valencia niet verliezen; In feite kunt u zelfs geen van zijn 4D -orbitalen verliezen, stabieler in energie vergeleken met 5s orbitaal. Daarom kunt u alleen de twee orbitale elektronen 5s verliezen2, Bijgevolg een tweewaardig metaal; Net als bij zink, kwik en alkalische metalen (Mr. Scholambara).
Wanneer het bestaan van het CD -kation wordt aangenomen in zijn verbindingen2+, Er wordt dan gezegd dat cadmium een +2 oxidatienummer of status heeft. Dit is het belangrijkste oxidatienummer. De volgende verbindingen bevatten bijvoorbeeld cadmium als +2: cdo (cd2+OF2-), Cdcl2 (CD2+Klet2-), CDSO4 (CD2+SW42-) en cd (nee3))2.
Naast dit oxidatienummer zijn er ook +1 (CD+) en -2 (CD2-)). Het oxidatienummer +1 wordt waargenomen in de CD -dicatie22+, waarin elk cadmiumatoom een positieve belasting heeft. Ondertussen is -2 vrij vreemd en zou het anion "cadmuro" aanvragen.
Waar is het en verkrijgt
 Greenockita -kristallen. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Greenockita -kristallen. Bron: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Cadmium is een zeldzaam element met een concentratie van 0,2 g / ton van de aardkorst. Het enige belangrijke mineraal van cadmium is Greenockita (CDS), dat niet wordt uitgebreid vanuit mijnbouw en commercieel oogpunt.
Kan u van dienst zijn: flocculatie: reactie, typen, toepassingen, voorbeeldenHet cadmium wordt geassocieerd met het zink in het Spheny -mineraal (ZnS), dat meestal een concentratie bevat die varieert tussen 0,1 % en 0,3 %; Maar in sommige gevallen kan de concentratie van cadmium in het sphaleriet 1,4 % bereiken.
Bewerkte rotsen om fosformeststoffen te verkrijgen, kunnen een cadmiumconcentratie van 300 mg / kg meststof hebben. Steenkool kan ook kleine, maar aanzienlijke hoeveelheden cadmium bevatten.
Een belangrijke bron van cadmium is de vulkanische emissies die het cadmium naar de oppervlaktewateren kunnen brengen. Het gebruik van fosfor -meststoffen in landbouwgebruik heeft geleid tot cadmiumbesmetting.
Het cadmium aanwezig in zure bodem is absorbeerbaar door groenten. Sommige groenten worden door de mens gebruikt als voedsel, wat verklaart hoe water en voedselinname de belangrijkste bron is van cadmiuminkomen bij mensen die niet -professioneel blootgesteld of roken.
Sphalerietbehandeling
Tijdens de mijnbouw, smelten en verfijnen van het zink aanwezig in het sphaleriet, wordt cadmium meestal verkregen als een secundair product. Een vergelijkbare gebeurtenis treedt ook op, hoewel in veel mindere mate tijdens koper- en loodverwerking.
Evenzo kunnen kleine hoeveelheden cadmium worden verkregen uit de recycling van ijzer- en staalafval.
De sprail wordt onderworpen aan toast zodat zinksulfide zijn oxide wordt, zno. Dezelfde reactie wordt geleden door cadmiumsulfide:
2 Zns + 3 O2 → 2 ZnO + 2 Dus2
Als dit mengsel van oxide wordt verwarmd met kolen, worden ze gereduceerd tot hun respectieve metalen:
Zno + Co → Zn + Co2
Evenzo kunnen zink en cadmium worden geproduceerd door elektrolyse bij het oplossen van oxiden in zwavelzuur.
Een van de twee methoden genereert een vijftig vervuild met cadmium. Bij het smelten kan het cadmium in een vacuüm worden gedestilleerd vanwege het lagere smeltpunt (321 ° C) vergeleken met die met CINC (420 ° C).
Isotopen
Onder de natuurlijke en stabiele isotopen van cadmium die we hebben, met hun respectieve overvloed hier op aarde:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
Hij 113CD is radioactief, maar vanwege de grote waarde van zijn halfleven (T1/2= 7,7 · 10vijftien jaren), kan als stabiel worden beschouwd. En dan is er de 116CD, ook radioactief, met een halve leven van 3,1 · 1019 Jaren, dus het kan worden beschouwd als een stabiele isotoop, die 7,51 % van de cadmium vertegenwoordigt.
Merk op dat de gemiddelde atoommassa 112.414 U is, dichterbij 112 dan 114. Het bestaan van een overheersende isotoop boven de anderen wordt niet waargenomen in de cadmium.
Risico's
Algemeen
Cadmiumabsorptie treedt voornamelijk op door voedsel, vooral lever, champignons, schaaldieren, poedercacao en droge algen.
In de vorige eeuw gebeurde er een emblematisch geval in China, waar een belangrijke vervuiling was met cadmium in de bevolking. Cadmiumvervuiling was te wijten aan de hoge concentratie in rijst, veroorzaakt door de aanwezigheid van cadmium in graanteeltgronden.
Een roker heeft een gemiddelde inname van 60 µg / dag. De maximale concentratie van het cadmium toegestaan in het bloed is 15 µg / dag. Niet -rokers hebben een concentratie cadmium in het bloed ongeveer 0,5 µg / l.
De longen absorberen tussen 40 en 60 % van het cadmium aanwezig in tabaksrook. Het cadmium geabsorbeerd in de longen wordt getransporteerd in het bloed en vormt complexen met eiwitten, cysteïne en glutationa, die vervolgens eindigen in de lever, nieren, enz.
Een acute cadmiuminhalatie kan symptomen veroorzaken die vergelijkbaar zijn met die waargenomen in een griepproces; zoals kou, koorts en spierpijn, kunnen longschade veroorzaken. Ondertussen kan chronische blootstelling aan cadmium longziekte, nieren en botten veroorzaken.
Effect op nieren
In de nieren veroorzaakt het cadmium meestal een verandering in fosfor- en calciummetabolisme, blijkt uit een toename van de productie van nierberekeningen. Bovendien veroorzaakt het nierschade die zich manifesteert in het uiterlijk in de urine van het retinoltransportproteïne en het β-2-microglobuline.
Reproductie -effect
Maternale blootstelling aan cadmium wordt geassocieerd met een laag gewicht van het kind bij de geboorte en een toename van de snelheid van spontane abortussen.
Botschade
Cadmium is in Japan gerelateerd aan de aanwezigheid van ITAI -itai -ziekte in de vorige eeuw. Deze ziekte wordt gekenmerkt door lage botmineralisatie, botfragiliteit met hoge breuksnelheid, verhoogde osteoporose en botpijn.
Kan u van dienst zijn: CD3: kenmerken, functiesCarcinogenese
Hoewel ratten -experimenten een relatie hebben gevestigd tussen cadmium en prostaatkanker, is dit niet aangetoond bij mensen. Een verband tussen cadmium en nierkanker is bewezen en is ook gekoppeld aan longkanker.
Toepassingen
Nikkel-cadmium oplaadbare bacteriën
 Verschillende batterijen of Ni-CD-batterijen. Bron: Boffy B via Wikipedia.
Verschillende batterijen of Ni-CD-batterijen. Bron: Boffy B via Wikipedia. Cadmiumhydroxide werd gebruikt als een kathode in NI-CD-batterijen. Deze werden gebruikt in de rail- en luchtvaartindustrie, evenals in instrumenten voor collectief gebruik, waaronder mobiele telefoons, camcorder, laptops, enz.
Cadmiumconsumptie voor de uitwerking van Ni-CD-batterijen vertegenwoordigde 80 % van de cadmiumproductie. Vanwege de toxiciteit van dit element zijn NI-CD-batterijen echter geleidelijk vervangen door nikkel-metaalhydride-batterijen.
Pig
 Cadmium rood. Bron: Marco Almbauer [Public Domain]
Cadmium rood. Bron: Marco Almbauer [Public Domain] Cadmiumsulfide wordt gebruikt als geel pigment en cadmium seleniuro als een rood pigment, bekend als Cadmio Red. Deze pigmenten worden gekenmerkt door hun schittering en intensiteit, dus ze zijn gebruikt in kunststoffen, keramiek, glas, email en artistieke kleuren.
Er is erop gewezen dat de schilder Vincent van Gogh cadmiumpigmenten in zijn schilderijen gebruikte, waardoor hij een verscheidenheid aan rood, oranje en heldergeel kon bereiken.
De kleuring van cadmiumpigmenten moet worden verzwakt voordat ze worden gemalen met oliën of gemengd in aquarellen en acryl.
Televisie
Componenten die cadmium bevatten, werden gebruikt in de fosfor van zwart -wit televisies, evenals in blauwe en groen.
Fosfor maakte deel uit van het scherm dat werd uitgestraald door kathodestralen, die verantwoordelijk was voor beeldvorming. Het cadmium is, ondanks zijn toxiciteit, begonnen te worden gebruikt op de Qled -televisies van recente creatie.
PVC -stabilisatie
Cadmiumverbindingen gevormd met carboxylaat, laureaat en staren werden gebruikt als polyvinylchloride -stabilisatoren, omdat ze de afbraak vertonen die wordt geproduceerd door blootstelling aan warmte en ultraviolet licht dat de PVC afbreekt tijdens het productieproces.
Vanwege de toxiciteit van het cadmium zijn de PVC-stabilisatoren verenigd in het cadmium vervangen door andere stabilisatoren, zoals barium, calciumzinc en de organostaño.
Legeringen
Cadmium is gebruikt in lagerlegeringen vanwege de hoge weerstand tegen vermoeidheid en lage wrijvingscoëfficiënt. Cadmium heeft een relatief laag smeltpunt, dus het wordt gebruikt in legeringen met lage melt en is component naast vele soorten lassen.
Cadmium kan ook worden gebruikt in legeringen van elektrische geleidbaarheid, thermische geleidbaarheid en elektrisch contact.
Aan het bedekken
Cadmium wordt gebruikt voor staalbescherming, aluminium en andere niet -ferrometaalfixeerelementen, evenals mobiele onderdelen. Cadmium coating levert corrosiebescherming in die zoutoplossing en alkalische media. Bovendien dient het als een smeermiddel.
Cadmium wordt ook gebruikt in veel elektrische en elektronische toepassingen die corrosieweerstand en lage elektrische weerstand nodig hebben.
Kernreactor
Cadmium wordt gebruikt in kernreactoren voor hun vermogen om neutronen op te vangen, waardoor overtollige neutronenproduct van nucleaire splijting kunnen worden gecontroleerd, waardoor extra nucleaire kloven worden vermeden.
Halfgeleiders
De seleniuro en cadmium telluriuro zijn verbindingen die de functie van halfgeleiders vervullen bij de detectie van licht en in zonnecellen. HGCDTE is gevoelig voor infraroodlicht en wordt gebruikt als een bewegingsdetector, evenals een schakelaar voor apparaten voor afstandsbediening.
biologie
 He-CD laserlicht. Bron: eerder anoniem (https: // www.Flickr.com/foto's/[e -mail beschermt]/35766549))
He-CD laserlicht. Bron: eerder anoniem (https: // www.Flickr.com/foto's/[e -mail beschermt]/35766549)) De helium-CD komt tussenbeide in de vorming van een blauw-violette laserstraal van een golflengte die varieert tussen 325 en 422 nm, bruikbaar in fluorescentiemicroscopen.
Cadmium wordt gebruikt in moleculaire biologie om calciumkanalen te blokkeren, afhankelijk van het membraanpotentiaal.
Referenties
- Wikipedia. (2019). Cadmium. Opgehaald uit: in.Wikipedia.borg
- Jungle V. R. & et al. (2014). Hoge druk en temperatuurstructuur van vloeistof en vaste CD: implicaties voor de smeltcurve van CD. Hersteld van: ResearchGate.netto
- Dr. Dough Stewart. (2019). Cadmium -elementenfeiten. Hersteld van: chemicool.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Cadmium. PubChem -database. CID = 23973. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Godt, J., Scheidig, f., Grosse-siestup, c., Esche, v., Brandenburg, p., Reich, a., & Groneberg, D. NAAR. (2006). De toxiciteit van cadmium en resulterende gevaren voor de menselijke gezondheid. Journal of Occupational Medicine and Toxicology (Londen, Engeland), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30 juli 2018). Feiten over Camium. Hersteld van: livescience.com
- De redacteuren van Enyclopaedia Britannica. (6 september 2018). Cadmium. Encyclopædia Britannica. Hersteld van: Britannica.com
- Internationale Cadmium Association. (S.F.)). Cadmium -toepassingen. Hersteld van: cadmium.borg
- Lentech B. V. (2019). Cadmium. Hersteld van: Lentech.com
- « Basale knooppunten functies, anatomie en pathologieën
- Geschiedenisparasitologie, wat studeer je?, Takken, concepten »

