Elektronentransportketencomponent, sequentie, remmers
- 3664
- 583
- Irving McClure I
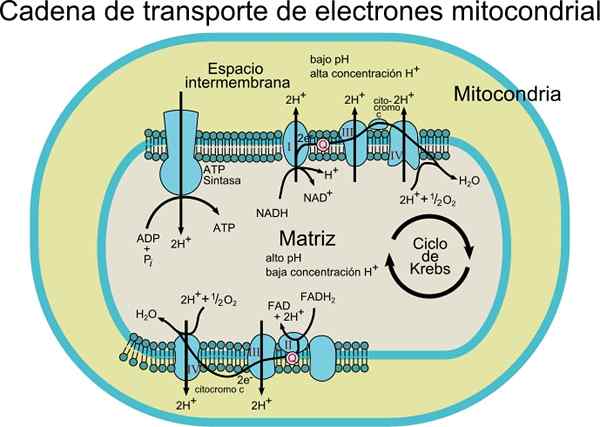
De elektronentransportieketting Het bestaat uit een set eiwit- en co -enzymmoleculen in een membraan. Zoals de naam al aangeeft, is het verantwoordelijk voor het transport van elektronen van de NADH- of FADH2 -co -enzymen naar de uiteindelijke ontvanger die O2 is (moleculaire zuurstof).
In dit transportproces wordt de energie die wordt vrijgegeven door elektronen van co -enzymen over te brengen naar moleculaire zuurstof door redoxcentra verenigd naar eiwit, geassocieerd met energieproductie (ATP). Deze energie wordt verkregen dankzij de protongradiënt die wordt gegenereerd in het mitochondriale interne membraan.
 Bron: Gebruiker: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/licenties/by-sa/2.5)]
Bron: Gebruiker: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/licenties/by-sa/2.5)] Dit transportsysteem bestaat uit verschillende componenten die te vinden zijn in ten minste twee oxidatietoestanden. Elk van hen wordt effectief verminderd en reoxyd tijdens de beweging van elektronen van NADH of FADH2 naar O2.
NAD+ en FAD -co -enzymen zijn verminderd in oxidatieroutes van vetzuren en de citroenzuurcyclus als gevolg van de oxidatie van verschillende substraten. Vervolgens worden deze co -enzymen geoxideerd in de elektronische transportketen.
Zodat het elektronische transportsysteem bestaat uit een reeks reacties van oxide-reductie die met elkaar zijn verbonden.
[TOC]
Kettingcomponenten
Afhankelijk van het type organisme kunnen 3 tot 6 componenten worden waargenomen die de elektronentransportieketen vormen. Het elektrontransportproces en ATP -synthese door oxidatieve fosforylering zijn processen die optreden in een membraan.
In het geval van prokaryotische cellen (aerobe bacteriën) gebeuren deze processen geassocieerd met het plasmamembraan. In eukaryotcellen komt het voor in het mitochondriale membraan, dus de elektrontransportcomponenten worden gevonden in het interne deel van het membraan.
https: // giphy.com/gifs/htksbbedquk9z7co5e
Elektronen worden geleidelijk overgebracht door vier complexen die de elektronische transportketen vormen.
Elk complex heeft verschillende eiwitcomponenten geassocieerd met prothetische groepen (niet -aminozuurcomponenten van conjugaateiwitten) redox, waardoor hun reductiepotentialen kunnen toenemen.
Bovendien bestaat dit transportsysteem uit verschillende moleculaire soorten zoals flavoproteïne; co -enzym dat ook Ubiquinona (CoQ of UQ) wordt genoemd; verschillende cytochromen zoals cytochroom B, C, C1, A en A3; Eiwitten met Fe-S en eiwitgroepen gekoppeld aan Cu. Deze moleculen zijn gekoppeld aan het membraan, met uitzondering van cytochrome c.
Complex I
https: // giphy.com/gifs/rlf1rl9GDC6356SJ6W
Het I-complex genaamd NADH Coenzyme Quinona Oxidortaduase, of NADH dehydrogenase, bestaat uit ongeveer 45 polypeptideketens en bevat een mononucleotide Flavine-molecuul (FMN) en acht tot negen Fe-S-groepen Fe-S. Zoals de naam al aangeeft, brengt dit complex een paar elektronen over van het NADH -co -enzym naar Coq.
De functie van het NADH -dehydrogenase -complex begint met de vereniging van NADH tot het complex aan de zijkant van de interne mitochondriale membraanmatrix. De elektronen worden vervolgens van NADH naar de FMN getransporteerd. Vervolgens passeren elektronen van de verminderde flavin (FMNH2) naar Fe-S-eiwitten.
De FMNH2 fungeert als een soort brug tussen de NADH en de Fe-S-eiwitten, omdat deze laatste slechts een enkel elektron kan overbrengen, terwijl het NADH-co-enzym twee overbrengt, zodat de flavina's deze overdracht maken van een enkel elektron dankzij zijn redox van de semi -fynone.
Kan u van dienst zijn: monocytopoiesis: fasen, kenmerken, regelgevingTen slotte worden de elektronen overgebracht van de FE-S-groeperingen naar het co-enzym Q, een mobiele elektronentransporteur met een isopreenide staart die het hydrofoob maakt, waardoor het midden van het mitochondriale membraan kan oversteken.
Complex II

Het II -complex, beter bekend als de succinaatdehydrogenase, is een integraal eiwit van het mitochondriale interne membraan en is een enzym dat tussenkomt in de citroenzuurcyclus.
Dit complex bestaat uit twee hydrofiele subeenheden en twee hydrofoob met hemo B-groepen die de CoQ-bindingsplaats bieden, naast een flavoproteïne en een eiwit met Fe-S.
In de citroenzuurcyclus (Krebs of tricarbonzuurcyclus) wordt succinaat omgezet in fumaraat door succinaatdehydrogenase, waardoor het co -enzym rand wordt gereduceerd tot fadh2. Van dit laatste co-enzym worden elektronen overgebracht naar de FE-S-centra die op hun beurt overbrengen naar de coq.
Tijdens de reacties van deze elektronenoverdracht is het standaard redox -potentieel zeer laag, waardoor de benodigde vrije energie wordt vrijgegeven om ATP te synthetiseren.
Dit betekent dat complex II het enige complex is in de elektrontransportketen die niet in staat is om energie te leveren voor ATP -synthese. Dit complex is echter van cruciaal belang in het proces, omdat het elektronen van FADH2 naar de rest van de keten overbrengt.
Complex III
https: // giphy.com/gifs/cjg0raiuizjds2hkyu
Het III -complex, cytochroomcomplex BC1 of Coq cytochroom C -reductase, draagt de elektronen van het gereduceerde co -enzym over naar de cytochroom C. Deze overdracht vindt plaats via een enkele redox -weg, die bekend staat als de Q -cyclus.
Dit complex bestaat uit een eiwit met Fe-S en drie verschillende cytochromen, waarbij het ijzeratoom in de Hemo-groep cyclisch varieert tussen de gereduceerde toestanden (Fe2+) en geoxideerd (Fe3+).
Cytochromen zijn hemoproteïnen van elektronisch transport, die redox -activiteit hebben. Ze zijn aanwezig in alle organismen, met uitzondering van enkele verplichte anaëroben.
Deze eiwitten hebben HEMO -groepen die afwisselen tussen twee oxidatietoestanden (Fe2+ en Fe3+). Cytochrome C is een mobiele elektronentransporter die zwak wordt geassocieerd met het interne membraan van mitochondria.
De cytochromen die in dit complex worden gevonden, zijn cytochromen B, C en A, de 3 zijn actieve redox -eiwitten met groepen We hebben verschillende kenmerken, die hun oxidatietoestanden wisselen tussen Fe2+ en Fe3+.
Cytochroom C is een perifeer membraaneiwit dat functioneert als een "shuttle" van elektron met cytochroom C1 en met het IV -complex.
IV complex
Cytochroom C en O2 zijn de uiteindelijke receptoren van elektronen die zijn afgeleid van de oxidatie van organisch materiaal, dus het IV- of cytochroom C -oxidase -complex is het terminale enzym in het elektronische transportproces. Dit accepteert elektronen uit cytochroom C en brengt ze over naar O2 -reductie.
De complexe functie is om oxidaties van een elektron van de vier opeenvolgende moleculen van verminderde cytochroom C te katalyseren, dat wil zeggen tegelijkertijd vier elektronen van een O2 -molecuul vermindert, waardoor uiteindelijk twee H2O -moleculen worden geproduceerd.
Kan u van dienst zijn: epitheliale coatingweefselElektrontransportvolgorde
De elektronen worden overgebracht van de complexen I en II naar de complex III dankzij het Coenzym Q, en van daaruit gaan ze naar het IV -complex door Cytochrome C. Wanneer de elektronen door deze vier complexen passeren, neemt het reductiepotentieel toe, waardoor energie wordt vrijgelaten, die vervolgens wordt gebruikt voor ATP -synthese.
In totaal veroorzaakt de overdracht van een paar elektronen de translocatie van 10 protonen door het membraan; Vier in complexen I en IV en twee van de complex III.
NADH Descidrogenasa
Dit enzym katalyseert de oxidatie van het NADH -co -enzym door het co -enzym dat. De elektronen gaan van de NADH naar de FMN die is bevestigd aan de hydrofiele staart van het complex I. Fe-S-groeperingen overbrengen naar elektronen tegelijk. Deze Fe-S-groepen verminderen tot de COQ, die is ingebed in het membraan, tot ubiquinol (gereduceerde CoQ).
Tijdens de overdracht van elektronen naar de COQ worden vier protonen op hun beurt overgebracht door het interne membraan, naar de intermembranale ruimte. Het mechanisme waarmee deze protonen worden getransloceerd, omvat eiwitten die zich in de hydrofobe staart van het complex I bevinden.
Het overdrachtsproces van elektronen geeft in deze stap vrije energie vrij, met name -16,6 kcal/mol.
Coq-Citocromo C-reductase en de Q-cyclus
Het co -enzym dat wordt geoxideerd door cytochroom C, in een reactie gekatalyseerd door dit co -enzym. De oxidatie van de ubiquinol (gereduceerde COQ) vindt plaats op een bepaalde plaats van het complex (QO of oxidatieplaats) in het mitochondriale membraan, waarbij twee elektronen worden overgebracht, één naar het eiwit met de Fe-S-groepen en een andere naar de Hemo-groepen.
In de Q -cyclus produceert de oxidatie van CoQ semi -quitonon, waar de elektronen worden overgebracht naar de Hemo B1- en BH -groepen. Terwijl deze elektronenoverdracht plaatsvindt, oxideert een tweede coq in de QO -site en herhalen de cyclus.
Deze cyclus veroorzaakt de overdracht van twee elektronen en op zijn beurt de translocatie van vier protonen naar de intermembranale ruimte, met de afgifte van -10,64 kcal/mol vrije energie.
Citocroma C oxidase
Dit enzym (complex IV) katalyseert de oxidatie van cytochroom C (gereduceerd) door O2, wat de uiteindelijke elektronenacceptor is. Deze overdracht produceert een H2O -molecuul voor elk paar elektronen overgedragen naast de translocatie van protonen door het membraan.
De elektronen bewegen van één naar één, van de verminderde cytochroom C tot een paar Cua -ionen, dan passeren ze naar een Hemo A -groep en bereiken uiteindelijk het binucleaire centrum van het complex dat Cub en Hemo A3 -ionen bevat, waar de overdracht van vier Elektronen komen voor bij zuurstof.
In het IV -complex brengen de elementen de elektronen van één voor één over, zodat de O2 geleidelijk wordt verminderd, zodat de afgifte van sommige toxische verbindingen zoals superoxide, waterstofperoxide of hydroxylradicalen niet optreedt.
De energie die in dit stadium wordt vrijgegeven, komt overeen met -32 kcal/mol. De elektrochemische gradiënt gegenereerd tijdens het overdrachtsproces en de energieveranderingen (AE) veroorzaakt door een paar elektronen bij het passeren van de vier complexen, komt in elke fase overeen met de vrije energie die nodig is voor de productie van een ATP -molecuul.
Kan u van dienst zijn: membraan vouwtheorieGrote dehydrogenase
Zoals gezegd, heeft dit complex de enige maar belangrijke functie van het introduceren van de FADH2 -elektronen van de citroenzuurcyclus naar de elektronentransportketen.
Dit enzym katalyseert de oxidatie van het FADH2 -co -enzym door het co -enzym Q (geoxideerd). In de citroenzuurcyclus Wanneer de succinaat tot fumaraat, worden twee elektronen en twee protonen overgebracht naar de rage. Vervolgens brengt de FADH2 deze elektronen over tot coq via de FE-S-centra van het complex.
Ten slotte worden de CoQ de elektronen overgebracht naar de complex III, volgens de hierboven beschreven stappen.
De kettingcomplexen zijn onafhankelijk
De vier complexen die de elektronische transportketen vormen, zijn onafhankelijk, dat wil zeggen dat ze onafhankelijk zijn en werken in het mitochcondriale interne membraan, en de beweging van elk in het membraan hangt niet af of is gekoppeld aan de andere complexen.
De I- en II -complexen bewegen in het membraan door hun elektronen over te brengen naar COQ die zich ook verspreidt in het membraan en brengt ze over naar complex III, vanwaar elektronen overgaan op cytochroom C die ook mobiel is in het membraan en elektronen in het IV -complex afzetten in het IV -complex.
Elektronische transportketenremmers
Op de elektronische transportketen werken enkele specifieke remmers in hun proces. Rothenone is een veelgebruikt insecticide dat stoichiometrisch is verbonden met complexe I, waardoor de vermindering van coq wordt vermeden.
Sommige barbituraten van type geneesmiddelen zoals piericidine en amytal, remmen de complex I en verstoren de overdracht van elektronen van de Fe-S-groepen naar de coq.
In complex II fungeren sommige verbindingen zoals theoiltrifluoroaceton en malonaat als competitieve remmers met succinaat, het vermijden van hun oxidatie en op zijn beurt de overdracht van elektronen naar de rage.
Sommige antibiotica zoals myxotiazol en stigmatelline, binden aan de Q-plaats van de COQ en remmen de overdracht van elektronen van het co-enzym Q naar de Fe-S-centra van de eiwitten.
Cyanide, Azida (N3-), zwavelzuur en koolmonoxide remmen het IV-complex. Deze verbindingen binden aan Hemo -groepen, waardoor de overdracht van elektronen naar het complexe of zuurstof (O2) binucleair centrum (O2) wordt vermeden.
Wanneer de elektronentransportketen wordt geremd, wordt de energieproductie gestopt door oxidatieve fosforylering, waardoor ernstige schade wordt veroorzaakt en zelfs de dood van het organisme.
Referenties
- Alberts, B., Bray, D., Hopkin, K., Johnson, a., Lewis, J., Raff, m., Roberts, K. & Walter, p. (2004). Essentiële celbiologie. New York: Garland Science. 2e editie.
- Cooper, G. M., Hausman, r. EN. & Wright, n. (2010). De cel. (PP. 397-402). ED. Marbán.
- Devlin, T. M. (1992). Textbook of Biochemistry: met klinische correlaties. John Wiley & Sons, Inc.
- Garrett, r. H., & Grisham, c. M. (2008). Biochemie. ED. Thomson Brooks/Cole.
- Rawn, J. D. (1989). Biochemie (nee. 577.1 rauw). ED. Inter-Amerikaanse McGraw-hill
- VOET, D., & Voet, J. G. (2006). Biochemie. ED. Pan -American Medical.
- « Elektrische anguila -kenmerken, habitat, reproductie
- Biozoos -kenmerken, morfologie, reproductie, voeding »

