Waterstofbromide (HBR)
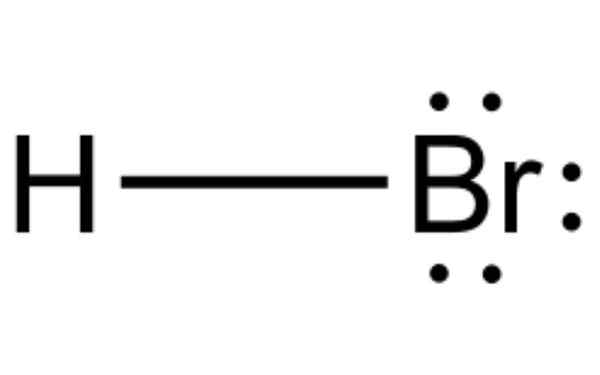
- 3918
- 241
- James Dach
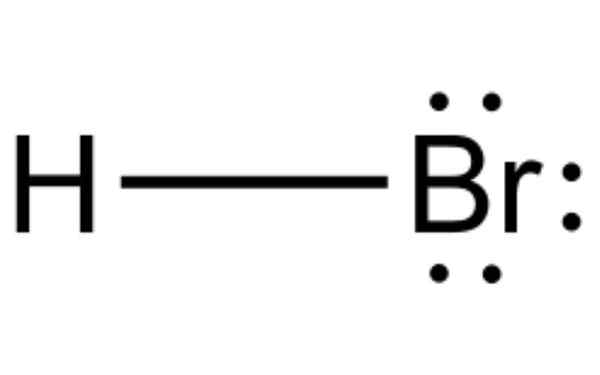 Waterstofbromide is een chemische verbinding die bromhorinezuur in water vormt. Bron: Rafał RX
Waterstofbromide is een chemische verbinding die bromhorinezuur in water vormt. Bron: Rafał RX Hij Waterstofbromide Het is een diatomee molecuul met een covalent binding. De verbinding wordt geclassificeerd als een waterstofhalogenide, een kleurloos gas dat is opgelost in waterbromhyterinezuur.
Fysische en chemische eigenschappen
- Waterstofbromide is een kleurloos gas bij kamertemperatuur, met een zure en irritante geur. De verbinding is stabiel, maar wordt enigszins donkerder wanneer deze wordt blootgesteld aan de lucht of het licht.
- Het heeft een molecuulgewicht van 80.91 g/mol en een dichtheid van 3.307 g/l, waardoor het zwaarder is dan de lucht. Het gas condenseert het produceren van een kleurloze kookvloeistof van -66,73 ° C.
- Door te blijven afkoelen, stolt de vloeistof, het verkrijgen van witte kristallen, waarvan het smeltpunt -86,82 ° C is, met een dichtheid van 2.603 g/ml.
- Waterstofbromide is meer in water oplosbaar dan waterstofchloride en kan 221 g oplossen in 100 ml water bij 0 ° C, wat gelijk is aan een volume van 612 liter van dit gas voor elke liter water. Het is ook oplosbaar in alcohol en andere biologische oplosmiddelen.
- In waterige oplossing (bromhydriczuur) zijn de zure eigenschappen van de HBR dominant (zoals het geval is van HF en HCl) en, in het verband tussen waterstof en halogeen, is het zwakker in het geval van waterstofbromide dan in de waterstofchloride.
Daarom, als chloor wordt geleid door het waterstofbromide, wordt de vorming van bruine dampen die kenmerkend is voor de moleculaire broom waargenomen. De reactie die verklaart is als volgt:
2HBr + Cl2 → 2HCl + BR2
Dit is een indicatie dat waterstofbromide een sterker reductiemiddel is dan waterstofchloride en dat waterstofchloride een beter oxidatiemiddel is.
- Waterstofbromide is een sterk watervrijzuur (zonder water). Reageer snel en exotherme met alle soorten basen (inclusief amines en amiden).
Kan u van dienst zijn: amines- Reageer exotherm met carbonaten (inclusief kalksteen en bouwmaterialen die het bevatten) en waterstofcarbonaten om koolstofdioxide te genereren.
- Reageert met sulfiden, carbiden, boruros en fosfon om giftige of brandbare gassen te genereren.
- Reageert met veel metalen (waaronder aluminium, zink, calcium, magnesium, ijzer, tin en alle alkalische metalen) om brandbaar waterstofgas te genereren.
Reactiviteit en gevaren
Waterstofbromide is een corrosieve en irritante verbinding. Het is extreem gevaarlijk in het geval van huidcontact (irritant en corrosief) en ogen (irritant) en in gevallen van inname en inademing (pulmonaal irriterend).
De verbinding wordt opgeslagen in containers van onder druk van vloeibaar gas. Langdurige blootstelling aan de intense warmte of warmte kan resulteren in de gewelddadige breuk van de onder druk staande container, die kan worden geactiveerd door irriterende giftige dampen vrij te geven.
Langdurige blootstelling aan lage concentraties of blootstelling aan korte termijn aan hoge concentraties kan leiden tot nadelige gezondheidseffecten als gevolg van inademing.
Thermische ontleding van watervrij waterstofbromide produceert giftige broom. Het kan ontvlambaar worden als het reageert door waterstof vrij te geven. In contact met cyanide produceert het giftige waterstofcyanidegassen.
Als deze chemische stof in oplossing in contact komt met de ogen, moeten ze onmiddellijk worden gewassen met grote hoeveelheden water, waardoor de onderste en bovenste oogleden af en toe worden opgeheven.
Er mogen geen contactlenzen worden gebruikt bij het werken met deze chemische stof. Als de oculaire stof is ingevroren, moet onmiddellijk medische hulp worden gevraagd.
Als het weefsel niet bevroren is, spoel de ogen onmiddellijk en volledig af met grote hoeveelheden water gedurende minimaal 15 minuten, en til de onderste en bovenste oogleden af en toe op.
Als deze chemische stof in oplossing in contact komt met de huid en geen bevriezing produceert, spoel de huid onmiddellijk met water besmet. Als je de kleding doordringt, bekijk het dan meteen en was de huid met water.
Kan u van dienst zijn: carbonzuurAls er bevriezing plaatsvindt, zoek dan onmiddellijk medische hulp. De aangetaste gebieden of spoelen met water mogen niet worden gewreven. Om meer weefselschade te voorkomen, moet u niet proberen bevroren kleding uit vorstgebieden te verwijderen.
Als grote hoeveelheden van deze chemische stof worden ingeademd, moet de persoon die wordt blootgesteld aan verse lucht onmiddellijk worden verplaatst. Als de ademhaling is gestopt, maak je mond -reanimatie van de mond. Het slachtoffer moet warm worden gehouden en in rust, naast het proberen om zo snel mogelijk medische hulp te krijgen.
Synthese
Gaseeuze waterstofbromide kan in het laboratorium worden vervaardigd door tetraline te bromeren (1, 2, 3, 4-tetrahydronaftaleen). Het nadeel is dat de helft van de broom verloren gaat. De opbrengst is ongeveer 94%, of wat hetzelfde is, 47% van de broomdoorts als HBR.
C10H12 + 4 Br2 → c10H8BR4 + 4 HBR
Waterstofbromidegas kan ook in het laboratorium worden gesynthetiseerd door reactie van zwavelzuur geconcentreerd op natriumbromide.
Nabr (S) + H2SW4 → hBr (g) + nahso4
Het nadeel van deze methode is dat veel van het product verloren gaat als gevolg van oxidatie met overtollig zwavelzuur om broom- en zwaveldioxide te vormen.
2 HBR + H2SW4 → Br2 + SW2 + 2 H2OF
Waterstofbromide kan in het laboratorium worden bereid door reactie tussen gezuiverde waterstof en broom. Dit wordt gekatalyseerd door platina asbest en wordt uitgevoerd in een kwartsbuis bij 250 ° C.
BR2 + H2[PT] → 2 HBR
U kunt ook kleinschalige watervrij waterstofbromide produceren voor trifenylfosfoniumtromure thermolyse in xyleen tot reflux.
U kunt HBR krijgen via de rode fosformethode. Eerst wordt de rode fosfor toegevoegd in de waterreactor en vervolgens, langzaam, de broom onder agitatie en de reactie van bromhorinezuur en fosforzuur, door sedimentatie, filtratie en de verkregen destillatie zijn bromhychloorzuur.
Kan u van dienst zijn: Stanislao CannizzaroP4+6 Br2+12 H₂o → 12 HBr + 4 H3Po3
Waterstofbromide bereid door de bovenstaande methoden kan worden vervuild met BR2, die kan worden geëlimineerd door het gas te passeren door een oplossing van fenol in tetrachloormethaan of ander oplosmiddel dat voldoende is bij kamertemperatuur, die 2, 4, 6-tribromofenol produceert en er meer HBR-.
Dit proces kan ook worden uitgevoerd via koperen chips of koperen gaas bij hoge temperatuur.
Toepassingen
- De HBR wordt gebruikt bij de productie van organische bromiden, zoals methylbromide, bromoethaan, enz., en anorganisch, zoals natriumbromide, kaliumbromide, lithiumbromide en calciumbromide, enz.
- Het wordt ook gebruikt in fotografische en farmaceutische toepassingen of voor de synthese van sedativa en anesthetica.
- Het wordt toegepast in industrieel drogen, textielafwerking, coatingmiddelen, oppervlaktebehandelingsmiddelen en ontsteking.
- Het wordt ook gebruikt om polysilicio -platen op te nemen, voor de productie van computerchips.
- Het is een goed oplosmiddel voor sommige metalen mineralen, gebruikt in metalen verfijning met hoge zuiverheid.
- In de olie -industrie wordt het gebruikt als een scheiding van alcoxi en fenoxy.
- Het wordt ook gebruikt in synthetische kleurstoffen en kruiden.
- De verbinding wordt gebruikt als een analytisch reagens bij de bepaling van zwavel, selenium, bismut, zink en ijzer, voor de scheiding van het blik van arseen en antimoon. Het is een alkylatiekatalysator en reducerend middel dat wordt gebruikt in de organische synthese.
- Het kan worden gebruikt voor de productie van bromhydriczuur.
- HBR is zeer reactief en corrosief voor de meeste metalen. Zuur is een veel voorkomend reagens in organische chemie, gebruikt voor oxidatie en katalyse.
Referenties
- Waterstofbromide. Ontleend bij ChemicalBook.
- Veiligheidsgegevensblad Waterstofbromide. Uit Sciencelab genomen.com.

