Aluminium bromide
- 1340
- 120
- Nathan Wiegand
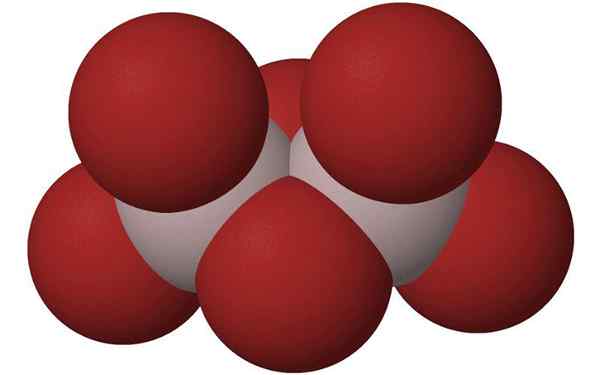
 Bollen van het aluminium bromide -dimeer. Bron: HOA112008, Wikimedia Commons
Bollen van het aluminium bromide -dimeer. Bron: HOA112008, Wikimedia Commons Wat is aluminium bromide?
Hij Aluminium bromide Het is een verbinding gevormd door een aluminiumatoom en een gevarieerde hoeveelheid broomatomen. Het wordt gevormd afhankelijk van de hoeveelheid valentie -elektronen die aluminium heeft.
Als een verbinding bevestigd door een metaal (aluminium) en een niet -metaal (broom), worden covalente bindingen gevormd die structuren een zeer goede stabiliteit geven, maar zonder die van een ionische binding te bereiken.
Aluminium bromide is een stof die normaal wordt gepresenteerd in een vaste toestand, met een kristallijne structuur. De kleuren van de verschillende aluminium bromuros verschijnen als bleke geel van verschillende tinten, en soms wordt het gepresenteerd zonder duidelijke kleur.
De kleur hangt af van de capaciteit voor lichte reflectie die de verbinding heeft en verandert afhankelijk van de gecreëerde structuren en de vormen die het neemt.
De vaste toestand van deze verbindingen kristalliseert, dus ze hebben goed gedefinieerde structuren met een uiterlijk vergelijkbaar met zeezout, maar variërend hun kleur.
Formule
Het aluminium bromide bestaat uit een aluminium (AL) atoom en door verschillende hoeveelheden broom (BR) atomen, afhankelijk van de valentie -elektronen die aluminium hebben.
Daarom kan de algemene formule voor aluminium bromide als volgt worden geschreven: AlbX, waar "x" het aantal broomatomen is dat bindt aan aluminium.
De meest voorkomende manier waarop het wordt gepresenteerd, is zoals de2BR6, dat is een molecuul met twee aluminiumatomen als hoofdbases van de structuur.
Kan u dienen: lactofenolblauw: kenmerken, samenstelling, voorbereiding, gebruikDe verbanden tussen hen worden gevormd door twee bromen in het midden, zodat elk aluminiumatoom vier broomatomen in zijn structuur heeft, maar op zijn beurt twee delen twee.
Eigenschappen en kenmerken van aluminium bromide
- Vanwege zijn aard is het zeer oplosbaar in water, maar het is ook gedeeltelijk oplosbaar in verbindingen zoals methanol en aceton, in tegenstelling tot andere stoffen.
- Het heeft een molecuulgewicht van 267 g/mol en wordt gevormd door covalente bindingen.
- Het natriumbromide bereikt zijn kookpunt op 255 ° C en bereikt zijn smeltpunt op 97.5 ° C.
- Een ander kenmerk van deze verbinding is dat het gifstoffen uitzendt tijdens het verdampen, dus het is niet raadzaam.
Toepassingen
- Een van de toepassingen die aan dit type substantie worden gegeven, vanwege de metalen en niet -metalen aard, is die van middelen in chemische tests van zuiverheden. Deze zuiverheidstests zijn erg belangrijk om de kwaliteit van reagentia te bepalen en producten te maken waarmee mensen tevreden zijn.
- In wetenschappelijk onderzoek wordt het op een zeer variabele manier gebruikt. Bijvoorbeeld, om complexe structuren te vormen, middelen in de synthese van andere waardechemicaliën, bij de hydrogenering van dihydroxinaftalenen en in selectiviteit in reacties, onder andere toepassingen.
- Deze verbinding is niet commercieel populair. Zoals hierboven gezien, heeft het enkele toepassingen die zeer specifiek zijn, maar zeer interessant voor de wetenschappelijke gemeenschap.
Referenties
- Chang, R. (2010). Scheikunde. McGraw-Hill Inter-American.
- Krahl, T., & Kemnitz, en. (2004). Amorfe eiringum bromide fluoride (ABF). Angewandte Chemie - Internationale editie.

