Kalium bifthalaatstructuur, nomenclatuur, gebruik, risico's
- 779
- 124
- Ernesto McKenzie
Hij kalium bifthalaat Het is een chemische, vaste, witte, oplosbare verbinding, die commercieel in een hoge zuiverheidstoestand is. Het wordt gebruikt als een primair patroon om oplossingen te standaardiseren in kwalificaties met zuurbasis; Het wordt ook gebruikt als een bufferoplossing om de pH van oplossingen stabiel te houden.
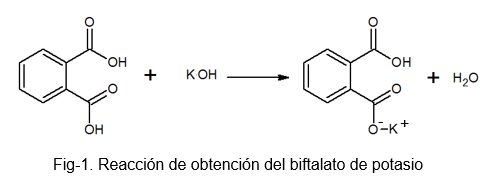
Het is een stabiele, niet -hygroscopische verbinding, die de bereiding van de oplossing vergemakkelijkt, omdat het geen water absorbeert tijdens het zware proces. Het kan worden bereid door de reactie tussen fotischzuur en een KOH -oplossing, waarbij een waterstof van het ftalzuurmolecuul wordt vervangen door een kaliumatoom.
Kalium bifthalaat ontvangt deze naam omdat er in zijn molecuul een enigszins zure waterstof is. Deze waterstof is degene die wordt gevonden in de -oH -groep die zich naast de carbonylgroep bevindt, die deel uitmaakt van het carboxyl dat niet reageert. Dit type zouten staan bekend als zuurzouten, omdat ze niet volledig neutraal zijn.
[TOC]
Chemische structuur

Formule
C6H4COOHCOOK = C8H5 Ko4
Nomenclatuur
- Kalium bifthalaat.
- Kaliumzuurftalaat.
- Kalium waterstof.
Eigenschappen
Dikte
1,636 g/ml.
Molaire massa
204.22 g/mol.
Oplosbaarheid
Water en alcohol.
Smeltpunt
295 ° C met ontleding.
Aspect
Wit -tot -White solide.
Specifiek gewicht
1.64 gr/cm3.
Kalium bifthalate derivaatstudie
Derichrografische metingen hebben aangetoond dat de ontleding van kaliumbifthalaat begint tussen 190 ° C en 200 ° C, en niet -hygroscopisch bereiding kan worden bereid tussen 100 ° C en 150 ° C.
De ontleding verloopt in drie stappen, waarvan de snelheid afhankelijk is van de snelheid in de temperatuurstijging: het dipbotassiumftalaat wordt eerst gevormd, het phtalische anhydride en het water worden geëlimineerd.
Kan u van dienst zijn: calciumchloride (CACL2)Entalpía -veranderingen kunnen ook worden verkregen uit het derivaat, dit produceert informatie over het aanvullende mechanisme van thermische ontleding en veranderingen van de toestand van het monster.
Gebruik en toepassingen
Deze verbinding wordt gebruikt in analytische chemie in de zuur-base titratie of beoordeling als een primair patroon voor standaardisatie bij het bereiden van oplossingen uit verschillende verbindingen.
Standaardisatie van een basis (alkali = NaOH)
Bij het voorbereiden van een NaOH -oplossing kan niet worden gegarandeerd dat de concentratie waarmee de oplossing blijft correct is; Dit komt omdat NaOH een zeer hygroscopische vaste stof is (absorberen lucht uit de lucht), en om het te wegen blijft het met enig vocht, waardoor de hoeveelheid substantie niet de meest optimale is.
Zodra de oplossing is bereid, is het noodzakelijk om precies te weten welke concentratie het is gebleven.
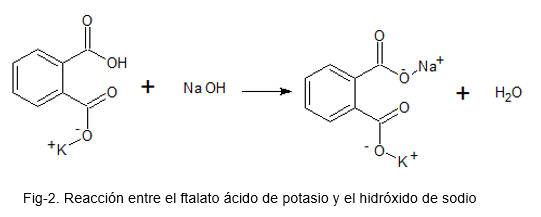
Hiervoor wordt een oplossing bereid met kaliumzuurftalaat, dat een primair patroon is (vanwege de hoge stabiliteit); Een paar druppels fenolfhaleïne zuur-base-indicator worden toegevoegd en de NaOH-oplossing als titel wordt toegevoegd totdat een roze kleur aanwezig is in de kaliumzuurftalaatoplossing.
Met de verkregen gegevens worden de relevante berekeningen gemaakt om de reële concentratie van de NaOH te vinden.
Het volgende beeld illustreert de chemische reactie tussen kaliumzuurftalaat en natriumhydroxide.

Als een bufferoplossing bij de bepaling van de pH
Een buffer- of bufferoplossing is degene die wordt gevormd door zowel zuur- als zuurzout, dit zorgt ervoor dat deze in omstandigheden blijft zodat de pH -waarde niet verandert wanneer kleine hoeveelheden zuur of basis worden toegevoegd.
Kan u van dienst zijn: Gravimetrie: Gravimetrische analyse, methoden, gebruik en voorbeeldenRisico's
- Brandblootstelling. Zoals bij de meeste organische vaste stoffen, is het mogelijk dat brand bij hoge temperaturen of door contact met een ontstekingsbron kan optreden.
- Het fijne stof verspreid in lucht in voldoende concentraties, en in aanwezigheid van een ontstekingsbron, is een potentieel van gevaarlijke stofexplosie.
- Het is een stabiele stof bij kamertemperatuur en in voldoende opslagomstandigheden. Overmatige hitte en vocht moeten worden vermeden.
- Het kan onverenigbaar zijn met sterke oxidatiemiddelen zoals salpeterzuur.
- Ontleding kan koolstofoxiden vormen die giftig zijn.
Wat betreft de gezondheid
- Door toevallige inname kan het braken, diarree en irritatie in de membranen veroorzaken vanwege hun zuurgraad.
- Door inademing veroorzaakt het irritatie in de luchtwegen en hoest.
- In de huid veroorzaakt het irritatie.
- In de ogen veroorzaakt het irritatie, roodheid en pijn.
- Er wordt aangenomen dat het geen carcinogene, teratogene of mutagene stof is.
Nood- en eerste hulp
- Was de ogen met veel water, verwijder vertraagt in het geval van het dragen ervan en het water door de ogen laten lopen zonder met de handen te worden aangeraakt.
- Als er contact was met de huid, verwijdert kostuums en schoeisel, was met veel water en was de kledingstukken heel goed voordat u opnieuw gebruikt.
- In het geval van inname, vermijd het uitlokken van braken, drinkwater.
- In het geval van inhalatie, neem de persoon mee om frisse lucht te ademen; Lever zuurstof in het geval van moeilijke adem.
- Vraag in alle gevallen dringende medische hulp.
- In het geval van lekken of morsen, verzamel het product in een schone container en probeer het stof niet te laten verspreiden.
Het kan u van dienst zijn: wat zijn de negatieve effecten die we hebben met oplosbaarheid in water?Persoonlijke beschermingsmaatregelen
- Blijf buiten de plek waar drankjes, eten en voeden worden opgeslagen (huisdierenvoedsel).
- Gebruik anti -stofmaskers, neopreen of PVC -handschoenen. Momenteel worden nitrilhandschoenen gebruikt.
- Draag voldoende kleding die het grootste deel van het lichaam bedekt, inclusief overdekte laarzen of schoen- en veiligheidsglazen.
- Lokale uitlaatventilatie wordt aanbevolen, met luchtextractorsysteem, rekening houdend met de overheersende windrichting.
- Het product is mengbaar in water, het wordt niet op de grond geabsorbeerd, het is niet bio -acumuleerbaar of biologisch afbreekbaar, het wordt niet verwacht dat het het waterleven beïnvloedt. Op het moment van het weggooien moet het echter worden gedaan met behulp van gespecialiseerd personeel: niet weggegooid door afvoeren.
- Bewaar in oranje/groene oppervlakte, vers droge en geventileerde plaats en gescheiden van onverenigbaar materiaal.
Referenties
- Merck, (s.f), Merckmillipore.com
- Chang R.,(1992), Chemistry, (vierde editie), Mexico, McGraw-Hill Inter-American uit Mexico S.A, van C.V
- Meyer chemie reagentia, (s.f), veiligheidsgegevensblad, kalium bifthalaat, hersteld van, reagentsmeyer.com.mx
- Belcher, r.,Erdey, l.,Paulik, f.,Liptay.G.,(Juli 1960), Kalium Hydrogenophthateftalate Fire, Wetenschappelijk, Deel 5, uitgave 1, Pagina's 53-57, org/10.1016/0039-9140 (60) 80205-6

