Arseengeschiedenis, structuur, eigenschappen, gebruik

- 3472
- 669
- James Dach
Hij arseen- Het is een semimetaal of metalloïde die behoort tot groep 15 of van het periodiek systeem gaat. Het wordt weergegeven door het chemische symbool als en heeft het atoomnummer 33. Het kan onder drie allotrope vormen zijn: geel, zwart en grijs; De laatste is de enige met industrieel belang.
Grijs arseen is een metaalachtige, fragiele uitziende vaste stof, met een stalen en kristallijne kleur (onderste afbeelding). Verliest zijn helderheid bij blootstelling aan luchtvorming arsenioso -oxide (als2OF3), die wanneer verwarmd een geur van knoflook uitzendt. Aan de andere kant zijn de gele en zwarte alotrocho's respectievelijk moleculair en amorf.
 Metalen arseen. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Metalen arseen. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Arseen bevindt zich in de aardkorst geassocieerd met talloze mineralen. Slechts een klein deel is in een native staat, hoe geassocieerd met antimoon en zilver ook.
Een van de meest voorkomende mineralen waarin arseen de volgende is, zijn: rejalgar (als4S4), de oropiment (als2S3), Loorlingita (lelijk2) en de enargita (cu3Ezel4)). Arseen wordt ook verkregen als een onderpandproduct van de gieterij van metalen zoals lood, koper, kobalt en goud.
Arseenverbindingen zijn giftig, vooral arsina (as3)). Arseen heeft echter tal van industriële toepassingen, waaronder legering met lood, gebruikt bij de uitwerking van autobatterijen, en de legering met het gallium met verschillende toepassingen in elektronica.
[TOC]
Geschiedenis van uw ontdekking
De 'arseen' -naam komt uit het Latijnse arsenicum en het Griekse arsenikon, verwijzend naar gele oropiment, die de belangrijkste vorm van het gebruik van arseen door alchemisten vormde.
Arseen lang voordat hij werd herkend als een chemisch element, was bekend en gebruikt in de vorm van zijn verbindingen. Bijvoorbeeld Aristoteles in de vierde eeuw.C. Hij schreef over de sandarache, een stof die nu wordt gedacht dat het arseen sulfide was.
Plinio El Viejo en Pivanio Discorides, in de 1e eeuw.C., Ze beschreven het oropiment, een mineraal gevormd door2S3. In de elfde eeuw werden drie soorten arseen erkend: wit (als4OF4), Het geel (als2S3) en rood (als4S4)).
Arseen als een puur element, werd voor het eerst waargenomen door Albertus Magnus (1250). Magnus verwarmd arseensulfide met zeep, waarbij het uiterlijk van een stof opmerken met een karakteristiek vergelijkbaar met het grijze beeldbeeld van het beeld. Het eerste authentieke rapport van zijn isolatie werd echter gepubliceerd in 1649 door Johann Schroeder, een Duitse apotheker.
Schroeder bereidde arseen door zijn kolenoxide te verwarmen. Vervolgens slaagde Nicolas Lémery erin het te verwarmen door een mengsel van arseenoxide, zeep en potas te verwarmen. In de 18e eeuw werd dit element uiteindelijk erkend als een semimetaal.
Het kan u van dienst zijn: geen elektrolyten: kenmerken en voorbeeldenArseenstructuur
Arseen is isomorf tegen antimoon; Dit is, structureel zijn ze identiek, alleen verschillend in de grootte van hun atomen. Elk atoom van arseen vormt drie as-as covalente bindingen, op zo'n manier dat ze ook zeshoekige eenheden ontstaan6 "Gerimpeld of steil", omdat de hybridisatie van As Atoms SP is3.
Dan de eenheden6 Ze verbinden zich te geven aan steile arseenlagen, die zwak met elkaar inwerken. In navolging van hun intermoleculaire krachten, voornamelijk afhankelijk van hun atoommassa's, geven de grijze arseenische rhomnenische kristallen de vaste stof een fragiele en brosse textuur.
Mogelijk vanwege de afstotingen van de arseen -elektronen, de eenheden6 Gevormd tussen parallelle lagen definiëren geen perfecte octaëder maar vervormd:
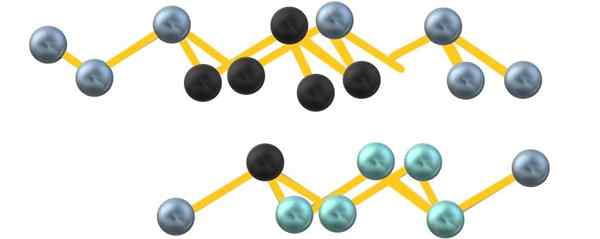 Grijze arseen kristallijne structuur. Bron: Gabriel Bolívar.
Grijze arseen kristallijne structuur. Bron: Gabriel Bolívar. Merk op dat de zwarte bollen het vervormde vlak trekken in de ruimte tussen twee steile lagen. Ook zijn er in de onderstaande laag blauwachtige bollen die, naast de zwarte bol, de eenheid vormen6 vermeld aan het begin van de sectie.
De structuur ziet er geordend uit, de rijen stijgen en gaan naar beneden, en is daarom kristallijn. Je kunt echter amorf worden, met geperste bollen van verschillende manieren. Wanneer grijsachtig arseen amorf wordt, wordt het een halfgeleider.
Geel arseen
Het gele arseen, de meest giftige alotrope van dit element, is een louter moleculaire vaste stof. Bestaat uit als moleculen4 eenheden door zwakke dispersiekrachten, die niet voorkomen dat ze volatiliceren.
Zwart arseen
Zwart arseen is amorf; Maar niet hoe kan de grijsachtige alotrope zijn. De structuur is enigszins vergelijkbaar met de recente6 Ze hebben grotere gebieden en verschillende aandoeningspatronen.
Elektronische configuratie
[AR] 3D104S24P3
Heeft alle orbitalen van niveau 3 vol. Vorm links met behulp van 4S en 4p orbitalen (evenals 4D) door verschillende chemische hybridisaties.
Eigenschappen
Molecuulgewicht
74.922 g/mol
Fysieke beschrijving
Grijs arseen is een grijsachtige metalen uitziende vaste en brosse consistentie.
Kleur
Drie allotrope vormen, geel (alfa), zwart (bèta) en grijs (gamma).
Geur
Toilet
Smaak
Smaakloos
Smeltpunt
1.090 K bij 35,8 atm (drievoudige arseenpunt).
Bij normale druk heeft geen fusiepunt, omdat het 887 k sublimeert.
Dikte
-Grijs arseen: 5,73 g/cm3.
Het kan u van dienst zijn: carbonylgroep: kenmerken, eigenschappen, nomenclatuur, reactiviteit-Geel arseen: 1,97 g/cm3.
Oplosbaarheid in water
Onoplosbaar
Atomaire radio
139 uur
Atoomvolume
13,1 cm3/mol
Radiocovolent
120 uur
Specifieke hitte
0,328 J/g · mol bij 20 ºC
Verdampingswarmte
32,4 kJ/mol
Elektronegativiteit
2,18 op de Pauling -schaal
Ionisatieenergie
Eerste ionisatie -energie 946,2 kJ/mol
Oxidatietoestanden
-3, +3, +5
Stabiliteit
Elementair arseen is stabiel in droge lucht, maar wanneer het wordt blootgesteld aan de vochtige lucht, is het bedekt met een geel-bronzen laag die een zwarte laag arseenoxide kan worden (2OF3)).
Ontleding
Wanneer arseen wordt verwarmd tot ontleding, straalt het een witte rook uit als2OF3. De procedure is gevaarlijk omdat Arsina ook kan worden uitgestoten, een zeer giftig gas.
Zelfstudie
180 ºC
Hardheid
3.5 op de MOHS Hardness Scale.
Reactiviteit
Het wordt niet aangevallen door koud zwavelzuur of geconcentreerd zoutzuur. Reageert met salpeterzuur of heet zwavelzuur, waardoor arseenzuur en arseenzuur wordt gevormd.
Wanneer grijs arseen wordt vervluchtigd door verwarming en dampen snel worden gekoeld, wordt een geel arseen gevormd. Dit keert terug naar de grijsachtige vorm, wanneer het wordt onderworpen aan ultraviolet licht.
Toepassingen
Legeringen
Een kleine hoeveelheid arseen toegevoegd om te leiden, verhardt zijn legeringen voldoende om ze te gebruiken in de voering van de kabels en in de uitwerking van autobatterijen.
De toevoeging van arseen aan het koper, een legering van koper en zink, verhoogt zijn weerstand tegen corrosie. Aan de andere kant corrigeert of vermindert het het verlies van zink in het koper, wat een toename van zijn nuttige levensduur veroorzaakt.
elektronica
Gezuiverd arseen wordt gebruikt in halfgeleidertechnologie waar het wordt gebruikt in combinatie met Gallic.
De GaAs heeft een direct bandinterval, dat kan worden gebruikt bij de productie van diodes, laser en LED. Naast Gallium Arseniuro zijn er andere arseniuros, zoals Indian Arseniuro en aluminium arseniuro, die ook II-V halfgeleiders vormen.
Ondertussen is Cadmium Arseniuro een halfgeleider van het type II-IV. Arsina is gebruikt in halfgeleider doping.
Landbouw en behoud van hout
De meeste toepassingen zijn weggegooid vanwege hun grote toxiciteit en die van hun verbindingen. De As2OF3 is gebruikt als pesticide, terwijl de aas2OF5 Het is een ingrediënt van herbiciden en insecticiden.
Arseenzuur (h3ASO4) en zouten zoals calcium- en loodarsenaat, zijn gebruikt om bodems te steriliseren en ongedierte te besturen. Dit genereert een risico op milieuvervuiling met arseen.
Kan u van dienst zijn: vloeibare elementen: wat zijn en voorbeeldenLood Arseniato werd gebruikt als een insecticide in fruitbomen, tot de eerste helft van de twintigste eeuw. Maar vanwege de toxiciteit werd het vervangen door natriummethylarsenaat, dat sinds 2013 om dezelfde reden niet meer werd gebruikt.
Geneeskrachtig
Tot de twintigste eeuw werden verschillende van hun verbindingen gebruikt als medicijnen. Arsfenamina en Neolsalvarsan werden bijvoorbeeld gebruikt bij de behandeling van syfilis en triposomiasis.
In 2000 werd het gebruik van de AS goedgekeurd2OF3, Zeer giftige verbinding, bij de behandeling van acute promineo-resistente beloofde belovende zuurzuur-overhandelt. Onlangs werd de radioactieve isotoop gebruikt 74Wat betreft de locatie van tumoren.
De isotoop produceert goede beelden, duidelijker dan die verkregen met de 124Ik, omdat jodium naar de schildklier wordt gebracht en ruis in het signaal produceert.
Andere gebruiken
Arseen werd in het verleden gebruikt als een additieve voeding bij de productie van pluimvee en varkens.
Het wordt gebruikt als katalysator in de productie van ethyleenoxide. Het wordt ook gebruikt in pyrotechniek en tan. Arsenioso -oxide wordt gebruikt als een ontluchting in de productie van glas.
Waar bevindt het zich?
Arseen kan in kleine hoeveelheden worden gevonden in een elementaire toestand, met een hoge mate van zuiverheid. Het is aanwezig in talloze verbindingen, zoals: sulfiden, arsenuros en sulfarseniuros.
Het wordt ook gevonden in verschillende mineralen, waaronder: arsenopyriet (FESAS), Loellingita (lelijk2), de enargita (cu3Ezel4), de oropiment (als2S3) En Rejalgar (als4S4)).
Hoe wordt het verkregen?
Arsenopirita wordt verwarmd tot 650-700 ºC, in afwezigheid van lucht. Arseen verdampt en laat ijzersulfide (FES) als residu achter. Tijdens dit proces bindt arseen aan zuurstof om te vormen4OF6, Bekend als de "witte arseen".
De As4OF6 Het is aangepast om de As te vormen2OF3, wiens dampen worden verzameld en gecondenseerd in een reeks bakstenen camera's, die arseen zuiveren door sublimatie.
Het grootste deel van het arseen wordt geproduceerd door de koolstof van het stof gevormd te verminderen2OF3.
Referenties
- Stephen R. Marsden. (23 april 2019). Chemie van arseen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Helmestine, Anne Marie, pH.D. (3 december 2018). Interessante feiten over arseen. Hersteld van: Thoughtco.com
- Wikipedia. (2019). Arseen. Opgehaald uit: in.Wikipedia.borg
- Dr. Dough Stewart. (2019). Arseen -elementenfeiten. Chemicool. Hersteld van: chemicool.com
- Royal Society of Chemistry. (2019). Arseen. Hersteld van: RSC.Of
- De redacteuren van Enyclopaedia Britannica. (3 mei 2019). Arseen. Encyclopædia Britannica. Hersteld van: Britannica.com
- « Kenmerken Minderheidsgroepen, typen, voorbeelden
- Reynolds nummer waar het voor is, hoe het wordt berekend, oefeningen »

