Alfa Amilasa -kenmerken, structuur, functies
- 4633
- 235
- Miss Herman Russel
De Alfa Amilasa (α-amylase) is een Amilolithisch enzym van de endo-ililasasgroep dat verantwoordelijk is voor de hydrolyse van de α-1,4-bindingen tussen de glucoseresten die verschillende soorten koolhydraten in de natuur vormen.
Systematisch bekend als systematisch bekend als α-1,4-glucan. Bij mensen bijvoorbeeld zijn de amylasen die aanwezig zijn in speeksel en die uitgescheiden door de alvleesklier van het type a-amylasen type.
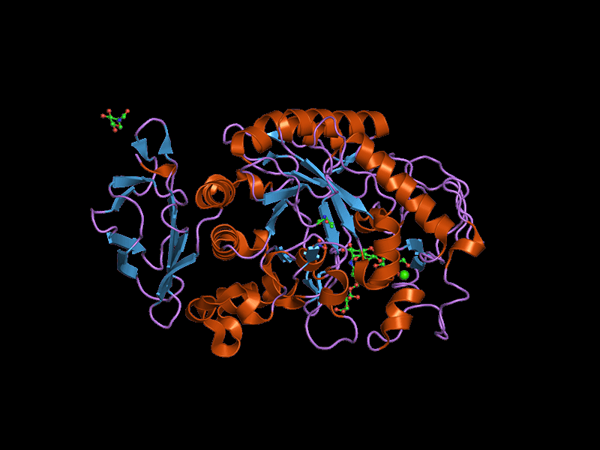
 C-terminale domeinstructuur van het Alfa Amilasa-dier (Bron: Jawahar Swaminathan en MSD-personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons)
C-terminale domeinstructuur van het Alfa Amilasa-dier (Bron: Jawahar Swaminathan en MSD-personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) Kuhn, in 1925, was de eerste die de term "a-amylase" munt op basis van het feit dat de producten van hydrolyse die deze enzymen katalyseren configuratie α hebben. Later, in 1968, werd vastgesteld dat deze bij voorkeur handelen op lineaire en niet -verbogen structurele configuratie -substraten.
Net als andere Amilolithische enzymen is a-amylase verantwoordelijk voor de hydrolyse van het zetmeel en andere gerelateerde moleculen zoals glycogeen, waardoor kleinere polymeren zijn samengesteld uit herhaalde eenheden van glucose.
Naast de fysiologische functies die dit enzym heeft bij dieren, planten en micro-organismen die het tot expressie brengen, vertegenwoordigen a-amylase, samen met de andere klassen van bestaande amylasen, 25% van de enzymen die worden gebruikt voor industriële en biotechnologische doeleinden de huidige markt.
Veel soorten schimmels en bacteriën zijn de belangrijkste bron voor het verkrijgen van de a-amylasen die vaker worden gebruikt in de industrie en wetenschappelijke experimenten. Dit is voornamelijk te wijten aan zijn veelzijdigheid, het zijn eenvoudig verkrijgen, zijn eenvoudige beheer en de lage kosten die verband houden met de productie.
[TOC]
Kenmerken
De a-amylasen die in de natuur worden gevonden, kunnen optimale pH-reeksen van een zeer verschillende pH hebben voor de werking ervan; Bijvoorbeeld, optimaal voor α-amylasen dieren en plant is tussen 5.5 en 8.0 pH -eenheden, maar sommige bacteriën en schimmels hebben meer alkalische enzymen en meer acidicas.
Kan u van dienst zijn: fylogenieDe enzymen die aanwezig zijn in speeksel- en zoogdierpancreas werken beter bij pH bijna 7 (neutraal), bovendien vereisen ze chloride -ionen om hun maximale enzymatische activiteit te bereiken en zijn in staat om Divalente Calciumionen aan te sluiten.
Zowel dieren, speeksel en pancreasenzymen worden geproduceerd in organismen door onafhankelijke mechanismen die specifieke cellen en klieren omvatten en die waarschijnlijk niet gerelateerd zijn aan de enzymen die aanwezig zijn in de bloedsomloopstroom en andere lichaamsholtes.
Zowel de pH als de optimale temperatuur voor het functioneren van deze enzymen hangt sterk af van de fysiologie van het organisme dat wordt overwogen, omdat er extremofiele micro -organismen zijn die in zeer specifieke omstandigheden groeien met betrekking tot deze en vele andere parameters.
Ten slotte is, in termen van de regulatie van zijn activiteit, een kenmerk dat wordt gedeeld tussen de enzymen van de groep α-amylasen dat deze, net als andere amylasen, kunnen worden geremd door zware metaalionen zoals kwik, koper, zilver en lood.
Structuur
Α-amylase is een multidominium-enzym dat bij dieren en planten een geschat molecuulgewicht van 50 kDa heeft en verschillende auteurs zijn het erover eens dat de enzymen die tot deze familie van glycohydrolesase behoren, enzymen zijn met meer dan tien structurele domeinen.
Het centrale domein of katalytische domein is zeer bewaard en staat bekend als domein A, dat bestaat uit een symmetrische vouw van 8 β-vergulde vellen gerangschikt in de vorm van een "vat" die zijn omgeven door 8 alfa-hallen, zodat je ook kunt vinden in de literatuur hoe (β/α) 8 of "tim" type vat.
Het is belangrijk op te merken dat aan het C-terminale uiteinde van de β-vellen van domein A het bewaarde aminozuurafval zijn dat betrokken is bij katalyse en bij de kruising van het substraat en dat dit domein zich bevindt in het N-terminale gebied van het eiwit.
Het kan je van dienst zijn: fauna en flora van de Peruaanse ZeeEen andere van de meest bestudeerde domeinen van deze enzymen is de zogenaamde Ding B, die opvalt tussen de β-peeled lamina en de alfa nummer 3 propeller van het domein a. Dit speelt een fundamentele rol in de unie van substraat en divalent calcium.
Extra domeinen zijn beschreven voor α-amylass-enzymen, zoals domeinen C, D, F, G, H en I, die zich aan de voor- of achterkant van het domein A bevinden en wiens functies niet precies bekend zijn en afhankelijk zijn van het organisme dat het wordt bestudeerd.
α-amylasen van micro-organismen
Het molecuulgewicht van a-amylasen hangt af, evenals andere biochemische en structurele kenmerken, van het bestudeerde organisme. Aldus hebben de a-amylasen van veel schimmels en bacteriën gewichten tot 10 kDa en zo hoog als 210 kDa.
Het hoge molecuulgewicht van sommige van deze microbiële enzymen is vaak gerelateerd aan de aanwezigheid van glycosilatie, hoewel glycosylering van eiwitten in bacteriën vrij zeldzaam is.
Functie
Bij dieren zijn a-amylasen verantwoordelijk voor de eerste stappen in het metabolisme van zetmeel en glycogeen, omdat ze verantwoordelijk zijn voor hun hydrolyse voor kleinere fragmenten. De organen van het gastro -intestinale systeem die de leiding hebben over hun productie bij zoogdieren zijn de alvleesklier en de speekselklieren.
Naast de voor de hand liggende metabole functie, wordt de productie van a-amylasen geproduceerd door de speekselklieren van veel zoogdieren, geactiveerd door norepinefrine-actie, door veel auteurs beschouwd als een belangrijke "psychobiologische" stressmarker in de stress in het centrale zenuwstelsel.
Het heeft ook secundaire functies in mondgezondheid, omdat de activiteit ervan werkt bij het elimineren van orale bacteriën en bij het voorkomen van de hechting ervan aan orale oppervlakken.
Het kan u van dienst zijn: Sympatric Speciation: Concept, Kenmerken en voorbeeldenHoofdfunctie in planten
In planten spelen a-amylasen een primaire rol bij de kieming van zaden, omdat het de enzymen zijn die het zetmeel in het endosperm hydrolyseren dat het embryo binnenin voedt, proces in wezen bestuurd door gibberine, een fytormoon, een fytormoon, een fytormoon, een fytormoon, een fytormoon.
Industriële toepassingen
Enzymen die behoren tot de familie van α-amylasen hebben meerdere toepassingen in veel verschillende contexten: industrieel, wetenschappelijk en biotechnologisch, enz.
In grote zetmeelverwerkingsindustrieën worden α-amylasen in de volksmond gebruikt voor de productie van glucose en fructose, evenals voor de productie van brood met verbeterde texturen en met een grotere loyale capaciteit.
In het biotechnologisch gebied bestaat er veel belangstelling voor de verbetering van de commercieel gebruikte enzymen, om hun stabiliteit en prestaties in verschillende omstandigheden te verbeteren.
Referenties
- Aiyer, p. V. (2005). Amylasen en hun toepassingen. African Journal of Biotechnology, 4(13), 1525-1529.
- Bernfeld, P. (1960). Amylasen, a en b. In Enzymen van koolhydraatmetabolisme (Vol. I, PP. 149-158).
- Granger, D. NAAR., Kivighan, K. T., Hen., Gordis, E. B., & Stud, l. R. (2007). Speeksel A-enlase in biobehavioraal onderzoek. Recente ontwikkelingen en applicaties. Ann. N.EN. Acade. Sci., 1098, 122-144.
- Monteiro, p., & Oliveira, p. (2010). Toepassing van microbiële A-enlase in de industrie- een beoordeling. Braziliaanse Journal of Microbiology, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, K. R. S. S. (2003). Een overzicht van de microbiële α-love-familie. African Journal of Biotechnology, 2(12), 645-648.
- Zout, w., & Shenker, s. (1976). Amylase- De klinische betekenis ervan: een overzicht van de literatuur. Geneesmiddel, 55(4), 269-289.
- Svensson, B., & MacGregor, en. NAAR. (2001). Relatie van sequentie en structuur met specificiteit in de A-amylase-familie van enzymen. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. NAAR., Spradlin, J. EN., & Dygert, s. (1925). Planten- en dieramylasen. Ann. Chem., 1, 115-189.
- « Reninstructuur, productie, secretie, functies
- Urie Bronfenbrenner -biografie, ecologisch model en bijdragen »

