Primaire alcoholstructuur, eigenschappen, nomenclatuur, voorbeelden

- 1860
- 48
- Dr. Rickey Hudson
A Primaire alcohol Het is er een waarin de hydroxylgroep is gekoppeld aan een primaire koolstof; Dit is een covalent bevestigde koolstof aan een andere koolstof en hydrogenen. Zijn algemene formule is ROH, met name RCH2Oh, omdat er maar één huurgroep is R.
De RCH Formula R Group R2Oh het kan iedereen zijn: een ketting, een ring of heteroatomen. Als het gaat om een ketting, kort of lang, is dit vóór de meest representatieve primaire alcoholen; Onder hen zijn methanol en ethanol, twee van de meest gesynthetiseerde op industrieel niveau.
 Bierpot: een voorbeeld van een waterige oplossing van ethylalcohol, een primaire alcohol, in een biologische matrix. Bron: Engin Akyurt via Pexels.
Bierpot: een voorbeeld van een waterige oplossing van ethylalcohol, een primaire alcohol, in een biologische matrix. Bron: Engin Akyurt via Pexels. Fysiek zijn ze als andere alcoholen, en hun kokende of fusiepunten zijn afhankelijk van de mate van hun gevolgen; Maar chemisch gezien zijn ze het meest reactief. Bovendien is de zuurgraad superieur aan die van secundaire en tertiaire alcoholen.
Primaire alcoholen ervaren oxidatiereacties en worden een breed aantal organische verbindingen: esters en ethers, aldehyden en carbonzuren. Ze kunnen ook uitdrogingsreacties lijden, alkenen of olefines worden.
[TOC]
Structuur van een primaire alcohol
Primaire alcoholen afgeleid van lineaire alkanen zijn de meest representatieve. In werkelijkheid kan elke structuur, of lineair of vertakt echter in dit type alcoholen worden geclassificeerd, zolang de OH -groep is gekoppeld aan een CH2.
Dus structureel heeft iedereen de aanwezigheid van de groep gemeen2Oh, methylol genoemd. Een kenmerk en gevolg van dit feit is dat de OH -groep minder wordt voorkomen; dat wil zeggen, het kan interageren met de omgeving zonder andere atomen die ruimtelijk belemmeren.
Ook betekent een minder voorkomen OH dat het koolstofatoom dat het draagt, de keuze2, kunnen vervangende reacties lijden via een SN -mechanisme2 (bimoleculair, zonder de vorming van een carbocatie).
Aan de andere kant vertaalt een OH met een grotere vrijheid om te communiceren met de omgeving, zich vertalen als sterkere intermoleculaire interacties (door waterstofbruggen), die op zijn beurt de fusie- of kookpunten verhoogt.
Het kan u van dienst zijn: nikkelhydroxide (iii): structuur, eigenschappen, gebruik, risico'sHet gebeurt ook met zijn oplosbaarheid in polaire oplosmiddelen, zolang groep R niet erg hydrofoob is.
Eigenschappen
Zuurgraad
Primaire alcoholen zijn van al het meest zuur. Om een alcohol te laten gedragen als een brnsted zuur, moet een ion h doneren+ in het midden, om water te zeggen, om een alcoxide -anion te worden:
ROH + H2GOUD- + H3OF+
De negatieve belasting van de rode-, Specifiek van de RCH2OF-, Voel minder afstoting van de kant van de elektronen van de twee C-H-bindingen, dan door de elektronen van de C-R-binding.
De huurgroep oefent vervolgens de grootste afstoting uit, destabilisatie van RCH2OF-; maar niet zozeer vergeleken met het feit dat als er twee of drie R -groepen zijn, zoals het geval is met respectievelijk secundaire en tertiaire alcoholen.
Een andere manier om de grootste zuurgraad van een primaire alcohol te verklaren, is door het verschil in elektronegativiteit, waardoor het dipoolmoment ontstaat: h2Cδ+-OFδ-H. Zuurstof trekt elektronische dichtheid aan beide CH aan2 vanaf H; De positieve gedeeltelijke belasting van koolstof stort op een beetje waterstof.
Groep R draagt een beetje over van zijn elektronische dichtheid naar Cho2, die helpt om zijn positieve gedeeltelijke belasting te verminderen en daarmee zijn afstoting voor de belasting van waterstof. Hoe meer RA -groepen, hoe lager de afstoting, en daarom de trend van H die moet worden vrijgegeven als h+.
Pka
Primaire alcoholen worden beschouwd als zwakste zuren dan water, met uitzondering van methylalcohol, die iets sterker is. De PKA van methylalcohol is 15,2; En de PKA van ethylalcohol is 16.0. Ondertussen is de water PKA 15.7.
Water dat wordt beschouwd als een zwak zuur, zoals alcoholen, kan echter lid worden van h+ Om te transformeren in het hydrium -ion, h3OF+; dat wil zeggen, het gedraagt zich als een basis.
Op dezelfde manier kunnen primaire alcoholen waterstof vangen; Vooral in sommige van de reacties die van zichzelf zijn, bijvoorbeeld in hun transformatie in alkenen of olefines.
Chemische reacties
Huur halogenuros -formatie
Alcoholen reageren met waterstofhalogeniden om alkylhalogeniden te produceren. De reactiviteit van de alcoholen voor de waterstofhalogeniden daalt af in de volgende volgorde:
Kan u van dienst zijn: koolstofTertiaire alcohol> Secundaire alcohol> Primaire alcohol
ROH +HX => RX +H2OF
RX is een primair alkylhalogenide (kies3CL, CH3Ch2Br, etc.)).
Een andere manier om alkylhalogenuros te bereiden, is door de reactie van Tionilo -chloride, een synthetisch reagens, met een primaire alcohol die een alkylchloride wordt. Tionilo -chloride (SOCL2) vereist om de aanwezigheid van pyridine te reageren.
Ch3(Ch2))3Ch2OH +SOCL2 => Ch3(Ch2))3Ch2Cl +SO2 + HCl
Deze reactie komt overeen met de halogenering van 1-penol om 1-clloropentano te worden in aanwezigheid van pyridine.
Oxidatie van primaire alcoholen
Alcoholen kunnen worden geoxideerd tot aldehyden en carbonzuren, afhankelijk van het reagens. Pyridinium chlorochromaat (PCC) oxideert primaire alcohol tot aldehyde, met behulp van het dichloormethaan als een oplosmiddel (CH2Klet2):
Ch3(Ch2))5Ch2OH => Cho3(Ch2))5Coh
Dit is de oxidatie van 1-heptanol in 1-heptanaal.
Ondertussen kaliumpermanganaat (kmno4) Alcoholalcohol eerst en vervolgens geoxideerd tot het aldehyde tot carbonzuur. Wanneer het kaliumpermanganaat wordt gebruikt om alcoholen te oxideren, moet het verbreken van het verband tussen koolstofatomen 3 en 4 worden vermeden.
Ch3(Ch2))4Ch2OH => Cho3(Ch2))4COOH
Dit is de oxidatie van 1-hexanol tot hexaanzuur.
Volgens deze methode is het moeilijk om een aldehyde te verkrijgen, omdat het een carbonzuur gemakkelijk oxideert. Een vergelijkbare situatie wordt waargenomen wanneer chroomzuur wordt gebruikt om alcoholen te oxideren.
E éteres formatie
Primaire alcoholen kunnen ethers worden wanneer ze worden verwarmd in aanwezigheid van een katalysator, meestal zwavelzuur:
2 RCH2OH => RCH2Och2R +H2OF
Organische ESARES -vorming
De condensatie van alcohol en een carbonzuur, visserverestering, gekatalyseerd door een zuur, produceert een ester en water:
Kan u van dienst zijn: carbocatie: vorming, kenmerken, typen, stabiliteitR'OH +RCOOH RCoor ' +H2OF
Een goed bekende reactie is die van ethanol met azijnzuur, om ethylacetaat te geven:
Ch3Ch2OH +CH3COOH CH3Kokos2Ch3 + H2OF
Primaire alcohol is het meest vatbaar voor fischer -sterificatiereacties.
Uitdroging
Bij hoge temperaturen en in een zuur medium, meestal zwavelzuur, dehydraat uitdagen om alkenen te veroorzaken met het verlies van een watermolecuul.
Ch3Ch2OH => H2C = Ch2 + H2OF
Dit is de uitdrogingsreactie van ethanol op ethyleen. Een meer geschikte algemene formule voor dit type reactie, met name voor een primaire alcohol, zou zijn:
RCH2Oh => r = cho2 (Wat ook gelijk is aan rc = ch2))
Nomenclatuur
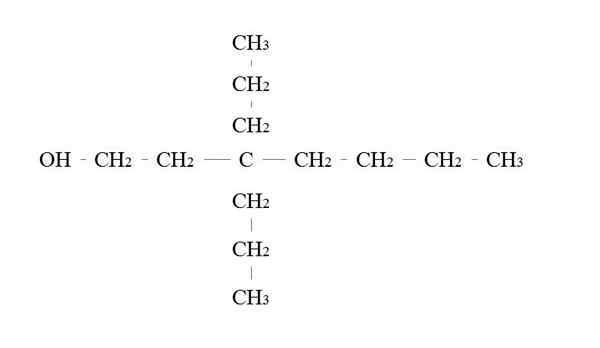 Primair alcoholvoorbeeld. Bron: Gabriel Bolívar.
Primair alcoholvoorbeeld. Bron: Gabriel Bolívar. De regels om een primaire alcohol te noemen zijn hetzelfde als voor de andere alcoholen; Met uitzondering, dat het soms niet nodig is om de drager van de OH op te sinnelen.
In de bovenste afbeelding is er een hoofdketen van zeven carbon. Koolstof gekoppeld aan de OH wordt het nummer van 1 toegewezen, en dan begint het van links naar rechts te tellen. De IUPAC-naam is daarom: 3.3-DietilHeptanol.
Merk op dat dit een voorbeeld is van een zeer vertakte primaire alcohol.
Voorbeelden
Ten slotte worden sommige primaire alcoholen genoemd volgens hun traditionele en systematische nomenclatuur:
-Methyl, ch3Oh
-Ethyl, ch3Ch2Oh
-N-propyl, ch3Ch2Ch2Oh
-N-hexyl, ch3Ch2Ch2Ch2Ch2Ch2Oh
Deze zijn afgeleid van lineaire alkanen. Andere voorbeelden zijn:
-2-fenylyletanol, c6H5Ch2Ch2Oh (c6H5 = benzeenring)
-2-propen-1-OC (Allilic Alcohol), Cho2= Chch2Oh
-1,2-taodiol, ch2Ohch2Oh
-2-chloortanol (ethyleclorhydrine), clch2Ch2Oh
-2-buten-1-ol (crotilische alcohol), ch3CH = CHCH2Oh
Referenties
- Morrison, r.T. En Boyd, r. N. (1987). Organische chemie. (5ta Editie). Addison-Wesley IberoAmericana
- Carey, f. NAAR. (2008). Organische chemie. (6ta Editie). McGraw-Hill, Intermerica, Editores S.NAAR.
- Mel Science. (2019). Hoe de oxidatie van primaire alcoholen plaatsvindt. Hersteld van: melscience.com
- Royal Society of Chemistry. (2019). Definitie: primaire alcoholen. Hersteld van: RSC.borg
- Chriss E. McDonald. (2000). De oxidatie van primaire alcoholen tot esters: drie gerelateerde onderzoeksexperimenten. J. Chem. Onderwijzer., 20000000000000000000, 77 (6), p 750. Doi: 10.1021/ED077P750
- « Actine -kenmerken, structuur, filamenten, functie
- Diamagnetisme -materialen, toepassingen, voorbeelden »

