Actine -kenmerken, structuur, filamenten, functie
- 3187
- 4
- Cecil Graham
De Actine Het is een cytosolisch eiwit dat microfilamenten vormt. In eukaryoten is actine een van de meest voorkomende eiwitten. Het vertegenwoordigt bijvoorbeeld 10% op gewicht van het totale eiwit in spiercellen; en tussen 1 en 5% van het eiwit in niet -muscle cellen.
Dit eiwit, naast de tussenliggende filamenten en microtubuli, vormt het cytoskelet, waarvan de belangrijkste functie de mobiliteit van de cel is, het behoud van celvorm, celdeling en de beweging van organellen in planten, schimmels en dieren.
 Bron: Sarcomere.SVG: David Richfield (Slashme-gebruiker) Derivaatwerk: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]
Bron: Sarcomere.SVG: David Richfield (Slashme-gebruiker) Derivaatwerk: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]] Isovormen van actine cytoskelet.
Vanuit evolutionair oogpunt is actine een zeer bewaard gebleven eiwit. Er zijn ongeveer 90% sequentiehomologie bij verschillende soorten. In eencellige organismen codeert een enkel gen voor een actine -isaform. Terwijl in meercellige organismen, coderen verschillende genen voor meerdere actine -isaforms.
De actine, samen met myosine, waren cruciale structuren in de evolutionaire toekomst van eukaryotische organismen en hun diversificatie, omdat ze beweging mogelijk maakten in afwezigheid van andere structuren, zoals flagella en cilia.
[TOC]
Structuur: actinefilamenten
Actine is een enkele polypeptideketen bolvormig eiwit. In de spier heeft het actine een moleculaire massa van ongeveer 42 kDa.
Dit eiwit heeft twee domeinen. Elk heeft twee subdomeinen en een kloof tussen de domeinen. De ATP-MG+2 sluit zich aan bij de onderkant van de kloof. De amino- en carboxil -terminals komen samen in subdomein 1.
Actina g en actina f
Er zijn twee belangrijke actinevormen: de actinemonomeer, genaamd Actina G; en een filamenteus polymeer, bestaande uit actine monomeren, genaamd Actina F. Actinefilamenten, waargenomen door elektronische microscopie, hebben respectievelijk 7 nm en 9 nm in diameter smalle en brede gebieden, respectievelijk 7 nm en 9 nm.
Gedurende het filament vormt Actin -monomeren een dubbele helix geperst. Een eenheid die in het hele filament wordt herhaald, bestaat uit 13 propellers en 28 actinemonomeren en heeft een afstand van 72 nm.
De actinefilament heeft twee uiteinden. Eén vormt de kloof die ATP-MG verbindt+2, die zich in dezelfde richting bevindt in alle actinemonomeren van de gloeidraad, het einde genoemd (-); En het andere uiteinde is het tegenovergestelde, het einde genoemd (+). Daarom wordt gezegd dat de actinefilament polariteit heeft.
Vaak staan deze componenten bekend als microfilamenten, omdat ze de componenten zijn van het cytoskelet die minder diameter vertonen.
Waar vinden we actine?
Actine is een extreem gemeenschappelijk eiwit in eukaryotische organismen. Van alle cel -eiwitten vertegenwoordigt actine ongeveer 5 tot 10% - afhankelijk van het celtype. In de lever heeft bijvoorbeeld elk van de cellen die het vormen bijna 5.108 Actinemoleculen.
Kenmerken
De twee vormen van actine, monomeer en gloeidraad worden voortdurend gevonden in een dynamische balans tussen polymerisatie en depolymeren. Over het algemeen zijn er drie kenmerken van dit fenomeen:
1) Actinefilamenten zijn typerend voor de structuur van spierweefsel en cytoskelet van eukaryotische cellen.
Kan u van dienst zijn: de 10 kenmerken van de meest opvallende lipiden2) Polymerisatie en depolimerisatie is een dynamisch proces dat wordt gereguleerd. Waarbij de polymerisatie of aggregatie van G-ATP-MG actinemonomeren+2 Het gebeurt aan beide uiteinden. Dat dit proces optreedt, hangt af van de omstandigheden van het medium en de regulerende eiwitten.
3) De vorming van balken en verloofde, die actine cytoskelet vormen, geeft kracht aan celmotiliteit. Dit hangt af van eiwitten die deelnemen aan de vorming van kruisbindingen.
Functie
Spiercontractie
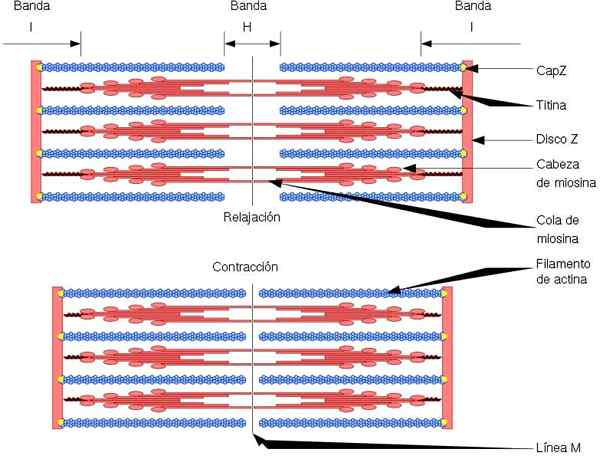
De functionele en structurele eenheid van de skeletspier is de sarcomer, die twee soorten filamenten heeft: dunne filamenten, gevormd door actine en dikke filamenten, gevormd door myosine. Beide filamenten zijn afwisselend georganiseerd, op een precieze geometrische manier. Sta spiercontractie toe.
Dunne filamenten zijn verankerd in regio's genaamd Discs Z. Deze regio bestaat uit een vezelnetwerk, waarin het CAPZ -eiwit zich bevindt, en waaraan de uiteinden (+) van actinefilamenten verankerd zijn. Dit anker voorkomt einddepolerisatie (+).
Aan de andere kant, aan de uiteinden (-) van actinefilamenten, bevindt tropomoduline zich en beschermt ze tegen depolymersie. Naast actine hebben dunne filamenten tropomiosine en troponine, die de functie hebben van het beheersen van actomiosine -interacties.
Hoe komt spiercontractie op?
Tijdens spiercontractie maken dikke filamenten draaibewegingen en trekken ze de dunne filamenten naar het midden van de sarcomere. Dit produceert het glijden van de dikke en dunne vezels.
Aldus blijft de lengte van de dikke en dunne filamenten constant, maar verhoogt de overlapping tussen beide filamenten. De lengte van de sarcomer neemt af door het verankeren van dunne filamenten naar de z -schijven.
Hoe stopt spiercontractie?
ATP is de energievaluta van de cel. Daarom is het bijna altijd beschikbaar in levende spierweefsels. Rekening houdend met het bovenstaande, moeten er mechanismen zijn die spierontspanning en de arrestatie van weeën mogelijk maken.
Twee eiwitten, genaamd tropomiosine en troponine, spelen een fundamentele rol in dit fenomeen. Deze werken samen om de vakbondssites van myosine te blokkeren (waardoor hun vereniging met actine wordt voorkomen). Als gevolg hiervan ontspant de spier.
Integendeel, wanneer een dier sterft ervaart een fenomeen dat bekend staat als Mortis -strengheid. De persoon die verantwoordelijk is voor deze verharding van het lichaam is de blokkade van de interactie tussen myosine en actine, kort na de dood van het dier.
Een van de gevolgen van dit fenomeen is de behoefte aan ATP voor de afgifte van de twee eiwitmoleculen. Logischerwijs is er geen ATP -beschikbaarheid in dode stoffen en deze release kan niet optreden.
Andere soorten beweging
Hetzelfde mechanisme dat we beschrijven (later zullen we het mechanisme die ten grondslag ligt, verdiepen) is niet beperkt tot de spiercontracties van dieren. Hij is verantwoordelijk voor de ameboidale bewegingen die we waarnemen in de amoeba's en in sommige koloniale mallen.
Op dezelfde manier wordt de cytoplasmatische beweging die we waarnemen in algen en landplanten geleid door vergelijkbare mechanismen.
Regulatie van polymerisatie en depolymerisatie van actinefilament
De samentrekking van glad spierweefsel en cellen produceert een actine F -toename en een afname van actine G. Actinepolymerisatie vindt plaats in drie fasen: 1) nucleatie, een langzame stap; 2) verlenging, een snelle stap; en 3) stabiele status. Polymerisatiesnelheid is gelijk aan depolymerisatiesnelheid.
Kan u van dienst zijn: Fixist Theory: Concept, postulates en auteursHet actinefilament groeit sneller met het einde (+) dan het einde (-). De verlengingssnelheid is evenredig met de concentratie van actinemonomeren in evenwicht met actinefilamenten, Kritische concentratie genoemd (CC).
De CC voor het uiteinde (+) is 0,1 µm, en voor het einde (-) is 0,8 µm. Dit betekent dat 8 keer minder concentratie van actinemonomeren vereist is om het einde te polymeriseren (+).
Actinepolymerisatie wordt voornamelijk gereguleerd door BetA4 -zwendel (TB4). Dit eiwit verenigt zich en behoudt het, waardoor polymeer wordt voorkomen. Terwijl propyline actinepolymerisatie stimuleert. Profiel bindt aan actinemonomeren die polymerisatie aan het einde vergemakkelijken (+), door dissociatie van het Actin-TB4-complex.
Andere factoren zoals ionen toenemen (NA+, K+ of mg+2) Geef de voorkeur aan de vorming van filamenten.
Actine cytoskeletvorming
De vorming van actine cytoskelet vereist de uitwerking van kruisbindingen tussen actinefilamenten. Deze links vormen eiwitten, waarvan de hoogtepunten zijn: ze hebben domeinen van Union to Actin; Velen hebben homologe domeinen voor calponine; en elk type eiwit wordt tot expressie gebracht in een bepaald type cel.
In filopoden en stressvezels worden kruisbanden tussen actinefilamenten gemaakt door fascin en Philamine. Deze eiwitten maken respectievelijk actinefilamenten parallel of hebben verschillende invalshoeken. Daarom definiëren actinefilamenten de vorm van de cel.
Het celgebied met de hoogste hoeveelheid actinefilamenten bevindt zich in de buurt van het plasmamembraan. Deze regio heet Cortex. Corticaal cytoskelet is georganiseerd in verschillende vormen, afhankelijk van het celtype, en verbindt met het plasmamembraan door het fixeren van eiwitten.
Enkele van de best beschreven cytoskeletten zijn spiercellen, bloedplaatjes, epitheelcellen en erytrocyten. In spiercellen verbindt het dystrofine -fixatieve eiwit bijvoorbeeld actinefilamenten met een uitgebreid glycoproteisch complex van het membraan. Dit complex bindt aan extracellulaire matrixeiwitten.
Actin-miosine interactiemodel
Rayment -geleide onderzoekers stelden een model met vier stappen voor om de interactie van actine en myosine te verklaren. De eerste stap vindt plaats met de Unie van ATP naar myosin heads. Deze vakbond genereert een conformationele verandering in het eiwit, waardoor deze van actine in het kleine filament wordt vrijgegeven.
Vervolgens wordt de ATP gehydrolyseerd tot ADP, waardoor een anorganisch fosfaat wordt vrijgelaten. Het myosinemolecuul is verankerd aan een nieuwe actinesubeenheid, waardoor een hoge energietoestand wordt gegenereerd.
De afgifte van anorganisch fosfaat brengt een verandering in myosine met zich mee, terugkerend naar de initiële conformatie en de beweging van de kleine filamenten, met betrekking tot de dikke filamenten, met betrekking tot de dikke filamenten. Deze beweging veroorzaakt de beweging van de twee uiteinden van de sarcomer en benadert ze.
De laatste stap omvat de release van ADP. Op dit punt is het hoofd van myosine gratis en kan het lid worden van een nieuwe ATP -molecuul.
Het kan u dienen: Biologie: geschiedenis, welke studies, takken, basesCelbeweging aangedreven door actinepolymerisatie
Rector Motility is een soort celmotiliteit. De stappen van dit type motiliteit zijn: projectie van de leidende as van hechting aan het substraat; hechting aan substraat; Achter terugtrekking; en des-adhesie.
De projectie van de leidende as vereist de deelname van eiwitten, die deelnemen aan de polymerisatie en depolimerisatie van actinefilamenten. De leidende as bevindt zich in de celcortex, genaamd lamellipodio. De projectiestappen van de as zijn:
- Receptoractivering door extracellulair signaal.
- Vorming van actieve GTPASA's en 4.5-bishoposfaatfosfoinositol (PIP2)).
- Wasp/litteken en ARP2/3 -eiwitactivering, die binden aan actinemonomeren om gevolgen te vormen in actinefilamenten.
- Snelle groei van actinefilamenten, aan het einde versierd met myosine, vertakking. De membraanstuwkracht wordt vooruit geproduceerd.
- Culminatie van verlenging geproduceerd door cover -eiwitten.
- ATP -hydrolyse bevestigd aan actine in de oudste filamenten.
- Depolimerisatie van de actine-AD van de filamenten gepromoot door ADF/Cofilina.
- ADP-uitwisseling door ATP gekatalyseerd door profylaine, die Actin G-ATP genereert, klaar om te beginnen met elongaire gevolgen.
Actine -gerelateerde ziekten
Spierdystrofie
Spierdystrofie is een degeneratieve ziekte van skeletspier. Het wordt recessief geërfd en is gekoppeld aan het X -chromosoom. Beïnvloedt voornamelijk mannen met een hoge frequentie in de bevolking (een op de 3.500 mannen). De moeders van deze mannen zijn asymptomatisch heterozygoot en kunnen geen familiegeschiedenis missen.
Er zijn twee vormen van spierdystrofie, Duchenne en Becker, en beide worden veroorzaakt door defecten in het dystrofine -gen. Deze defecten bestaan uit deleties die axonen elimineren.
Dystrofine is een eiwit (427 kDa) dat kruisbindingen vormt tussen actinefilamenten. Het heeft een beheersing van de vakbond om te actine in de N-terminale, en een beheersing van de membraanunie in de C-terminale. Tussen beide domeinen is er een derde buisvormig domein gevormd door 24 tandemherhalingen.
In het spiercorticale reticulum neemt dystrofine deel aan de unie van actinefilamenten aan het plasmamembraan door een glycoproteisch complex. Dit complex bindt ook aan extracellulaire matrixeiwitten.
Bij patiënten die functionele dystrofine missen, met Duchenne's spierdystrofie, ondersteunt corticaal cytoskelet het plasmamembraan niet. Bijgevolg wordt het plasmamembraan beschadigd door de stress van herhaalde spiercontracties.
Referenties
- Devlin, T.M. 20000000000000000000. Biochemie. Redactionele terugvordering, Barcelona.
- Gunst, s.J., en Zhang, W. 2008. Actine cytoskeletale dynamiek in gladde spieren: een nieuw paradigma voor de regulatie van gladde spiercontractie. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, een., Zipurski, s.L., Matsudaria, p., Baltimore, D., Darnell, J. 2003. Cellulaire en moleculaire biologie. Redactionele medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Nelson, D. L., Cox, m. M. 2008. Lehninger-Principles of Biochemistry. W.H. Freeman, New York.
- Pfaendtner, J., Van het kruis, en. M., Voth, g. 2010. Actinefilament remodellering door actine -depolymerisatiefactor/cofilin. PNAS, 107: 7299-7304.
- Pollard, T.D., Borisy, g.G. 2003. Cellulaire motiliteit aangedreven door assemblage en demontage van actine -fillamenten. Cell, 112: 453-465.
- « Apolipoproteïnen wat zijn, functies, typen
- Primaire alcoholstructuur, eigenschappen, nomenclatuur, voorbeelden »

