Isoamilico alcoholische structuur, eigenschappen, gebruik en risico's
- 1804
- 100
- Glen Armstrong
Hij Isoamylalcohol Het is een organische verbinding waarvan de formule is (ch3))2Chch2Ch2Oh. Chemisch gezien is een vertakte primaire alcohol en vormt een van de pentanol -isomeren, genaamd Amylalcoholen (C5H12OF).
Zoals veel alcoholen met een laag molecuulgewicht, is het een kleurloze vloeistof bij kamertemperatuur. Dit staat en vergemakkelijkt dat het wordt gebruikt als een oplosmiddel voor verschillende toepassingen; Bovendien, wanneer het niet te veel negatieve effecten op het ecosysteem uitoefent na het weggooien.
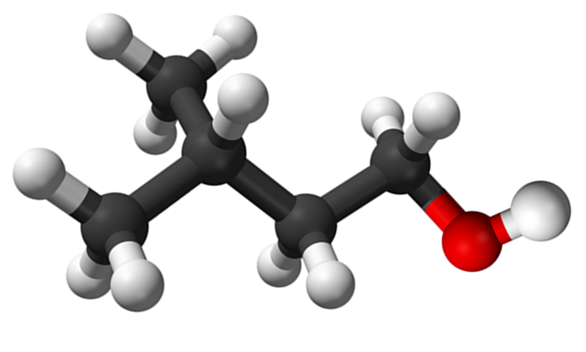
 Isoamilisch alcoholmolecuul. Bron: Claudio Pistilli de Wikipedia.
Isoamilisch alcoholmolecuul. Bron: Claudio Pistilli de Wikipedia. Hoewel het een intermediair materiaal is in de synthese van Amilo -acetaat voor de uitwerking van bananengeuren, is de eigen geur onaangenaam en vergelijkbaar met die van peren.
Naast het dienen als een oplosmiddel van meerdere biologische stoffen, en als een intermediair bij de synthese van andere acetaten, vermindert het de oppervlaktespanning van bepaalde industriële formuleringen, waardoor schuimen worden voorkomen. Daarom wordt het gebruikt in micro -geëmuleerde systemen.
Wat betreft zijn natuurlijke oorsprong, is isoamilische alcohol gevonden in de horomonas van de horzels, en in de zwarte truffels, een soort schimmels in het Europese zuidoosten.
[TOC]
Isoamilico structuur
In het bovenste beeld werd het isoamylalcoholmolecuul weergegeven met een bollen en barsmodel getoond. Rechts van hetzelfde komt de roodachtige bol overeen met het zuurstofatoom van de OH -groep, kenmerkend voor alle alcoholen; Terwijl hij links is, is er het koolzuurhoudende skelet met een methylgroep, cho3, De structuur bannen.
Vanuit moleculair oogpunt is deze verbinding dynamisch voor het hebben van atomen met SP -hybridaties3, het vergemakkelijken van de rotatie van hun links; Zolang het de OH en Cho niet ertoe brengt om te verduisteren3.
Het is ook de moeite waard om zijn amfifiele kenmerk te vermelden: het heeft een apolair of hydrofoob einde, gevormd door de keten (CH3))2Chch2Ch2-, en een polaire of hydrofiel hoofd, de OH -groep. Deze definitie van twee specifieke gebieden van verschillende polariteiten maakt deze alcohol een tensactief; En vanaf hier is het de toepassing ervan voor micro -emulsies.
Kan u van dienst zijn: hendelregelIntermoleculaire interacties
Gezien de aanwezigheid van de OH -groep, presenteert het isoamilische alcoholmolecuul een permanent dipoolmoment. Bijgevolg is het dipool-dipol.
Terwijl de tak van de hoofdketens effectieve interacties tussen moleculen vermindert, compenseren waterstofbruggen in deze alcohol voor deze afdaling, waardoor de vloeistof kookt bij 131 ° C, temperatuur hoger dan het kookpunt van water.
Het gebeurt niet met zijn vaste of "ijs", die smelt tot -117 ° C, aangeeft dat zijn intermoleculaire interacties niet sterk genoeg zijn om hun moleculen ordelijk te houden; Vooral als de CHO -groep3 die vertakt de hoofdketen voorkomt beter contact tussen moleculen.
Eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof.
Ruiken en smaak
Verwerpt een onaangename geur vergelijkbaar met die van de peer, en heeft een scherpe smaak.
Molaire massa
88,148 g/mol.
Dikte
0.8104 g/ml bij 20 ° C. Het is daarom minder dicht dan water.
Dampdichtheid
Het is 3,04 keer dichter dan lucht.
Dampdruk
2,37 mmHg bij 25 ° C.
Kookpunt
131.1 ° C.
Smeltpunt
-117,2 ° C.
ontstekingspunt
43 ° C (gesloten beker).
Zelf -richtingtemperatuur
340 ° C.
Oplosbaarheid
Het is relatief oplosbaar in water: 28 g/l. Dit komt omdat de sterk polaire moleculen van het water geen speciale affiniteit voelen voor de koolzuurhoudende isoamylalcoholketen. Indien gemengd, zouden twee fasen worden waargenomen: een lagere, overeenkomend met water, en een superieur, die van isoamylalcohol.
Het is daarentegen veel meer oplosbaar in minder polaire oplosmiddelen zoals: aceton, ether, chloroform, ethanol of ijsazijn; en zelfs in olieether.
Het kan u van dienst zijn: Laboratoriumthermometer: kenmerken, waarvoor is het, gebruik, voorbeeldenSmurrie
3.738 CP bij 25 ° C.
Oppervlaktespanning
24.77 DIN/CM A 15 ° C.
Brekingsindex
1.4075 tot 20 ° C.
Warmte capaciteit
2.382 kJ/g · k.
Toepassingen
Grondstof
From isoamilic alcohol other esters, thiophene, and drugs such as amilo nitrite, Validol (isavalerate mentile), bromisoval (bromobalerilurea), Corvalol (a callerian tranquanar) and Barbamil (amobarbital) (amobarbital).
Geuren
Naast het worden gebruikt voor de synthese van Amilo -acetaat, dat een bananenaroma heeft, worden andere fruitgeuren zoals abrikozen, sinaasappels, pruimen, kers en mout er ook van verkregen. Daarom is het een noodzakelijke alcohol bij de uitwerking van talloze eetbare of cosmetica -producten.
Antispumant
Door de oppervlaktespanning te verminderen, bevordert het het gebruik ervan in micro -geëmuleerde systemen. Vermijd praktisch versnelde bellenvorming, waardoor ze in grootte worden verkleind om ze te breken.
Het helpt ook om de interface tussen waterige en organische fasen tijdens extracties beter te definiëren; Het wordt bijvoorbeeld toegevoegd aan het fenol-chloroformextractormix in een 25: 1 aandeel. Deze techniek is bedoeld voor DNA -extractie.
Extracties
Met isoamylalcohol kunt u ook vetten of oliën uit verschillende monsters extraheren, bijvoorbeeld melk. Los ook paraffinewas, inkten, rubber, lakken en cellulose -esters op.
Doorgaan met extracties, kunt u fosforzuur verkrijgen van ijzerfosfatische minerale oplossingen.
Risico's
Opslag en reactiviteit
Zoals elke vloeistof die geuren afgeeft, kan het een naderend vuurrisico vertegenwoordigen als de plaats waar de temperatuur te bewaart, nog meer is, als er al een warmtebron is.
Onder deze omstandigheden fungeert het gewoon als een brandstof, het voeden van de vlammen en het benutten van zijn container. Breng dampen vrij die de gezondheid kunnen beïnvloeden en de verstikking kunnen veroorzaken.
Kan u van dienst zijn: Kwantitatieve analyse in chemie: metingen, voorbereidingAndere oorzaken dat isoamilische alcohol in brand wordt gestoken, is het mengen of laten reageren met stoffen zoals: peroxiden, brome.
Gezondheid
Bij contact met de huid kunt u deze irriteren en uitdrogen. De symptomen zijn echter ernstiger als het te lang wordt ingeademd (hoest, neusverbrandingen, keel en longen), of indien ingenomen (hoofdpijn, misselijkheid, diarree, braken, duizeligheid en verlies van kennis).
En ten slotte, wanneer het in de ogen morste irriteert ze en kan ze zelfs onomkeerbaar schaden. Gelukkig stelt de geur van "alcoholische peren" je in staat om het te detecteren in geval van ontsnapping of morsen; Bovendien is het een verbinding die met respect moet worden gemanipuleerd.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Wikipedia. (2019). Isoamylalcohol. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Isoamylalcohol. PubChem -database. CID = 31260. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Zhang Yu & Muhammed Mamoun. (17 september 2008). Extractie van fosforzuur uit nitraatoplossingen met isoamylalcohol. Extractie oplosmiddel en ionenuitwisseling Volume 6, 1988 - Uitgave 6. doen.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamylalcohol. [PDF]. Hersteld van: nj.Gov
- Kat Chem. (2019). Isoamylalcohol. Hersteld van: Kat-Chem.Hu
- Chemoxy International Ltd. (S.F.)). Isoamylalcohol. Hersteld van: chemoxy.com
- « Triethilamine -structuur, eigenschappen, gebruik en risico's
- Liechtenstein vlaggengeschiedenis en betekenis »

