Triethilamine -structuur, eigenschappen, gebruik en risico's

- 4681
- 283
- Dr. Rickey Hudson
De triethilamine Het is een organische verbinding, meer precies een alifatisch amine, waarvan de chemische formule N is (CH2Ch3))3 of net3. Net als andere vloeibare amines presenteert het een geur vergelijkbaar met die van de ammoniak gemengd met vissen; Zijn dampen maken vervelend en gevaarlijk deze stof manipuleren zonder een geschikte extractor of kleding.
Naast zijn respectieve formules wordt het meestal afgekort aan deze verbinding als ASD; Dit kan echter verwarring veroorzaken met andere amines, zoals trietanolamine, n (ethoh)3, of het tetraetilamonium, een quaternair amina, net4+.
 Triethylamine skelet. Bron: Mixtures [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]
Triethylamine skelet. Bron: Mixtures [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]] Uit zijn skelet (superieure beeld) kan worden gezegd dat triethylamine vrij gelijkaardig is aan de ammoniak; Terwijl de tweede drie hydrogenen heeft, NH3, De eerste heeft drie ethylgroepen, n (ch2Ch3))3. De synthese begint bij de behandeling van vloeibare ammoniak met ethanol, waardoor een alkylering plaatsvindt.
Het net3 U kunt een hygroscopisch zout vormen met HCl: triethilamine hydrochloride, net3· HCl. Daarnaast neemt hij deel als een homogene katalysator in de synthese van esters en amidas, dus het is een noodzakelijk oplosmiddel in organische laboratoria.
Ook kan het samen met andere reagentia respectievelijk de oxidatie van primaire en secundaire alcoholen tot aldehyden en ketonen toestaan. Zoals ammoniak een basis is, en daarom kan het organische zouten vormen door neutralisatiereacties.
[TOC]
Structuur van triethylamine
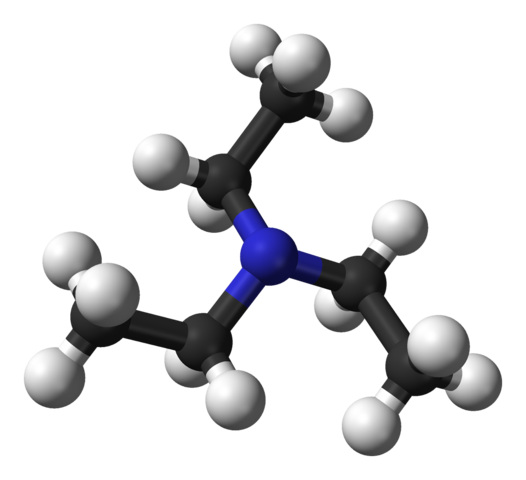 Structuur van triethylamine. Bron: Benjah-bmm27 [Public Domain].
Structuur van triethylamine. Bron: Benjah-bmm27 [Public Domain]. Het bovenste beeld toont de structuur van het triethylamine met een model van bollen en staven. In het midden van het molecuul bevindt het stikstofatoom zich, voorgesteld door een blauwachtige bol; En gekoppeld aan hem, de drie ethylgroepen, zoals kleine takken van zwarte en zwarte bollen.
Hoewel ze niet met het blote oog zijn, zijn er op het stikstofatoom een paar niet gedeelde elektronen. Deze twee elektronen en de drie groepen -ch2Ch3 Ze ervaren elektronische afstotingen; Maar aan de andere kant dragen ze bij om het dipoolmoment van de molecuul te definiëren.
Kan u van dienst zijn: cycloalcanos: eigenschappen, reacties, gebruik, voorbeeldenEen dergelijk dipoolmoment is echter lager dan dat van bijvoorbeeld diethylamine, nhet2; En het ontbreekt ook aan elke mogelijkheid om waterstofbruggen te vormen.
Dit komt omdat er in de triethylamine geen N-H-binding is, en bijgevolg worden kleine fusie- en kookpunten waargenomen in vergelijking met andere amines die op zo'n manier interageren.
Hoewel er een licht dipoolmoment is, kunnen dispersiekrachten tussen ethylgroepen van netto moleculen niet worden uitgesloten3 buren. Door dit effect toe te voegen, is het gerechtvaardigd waarom, hoewel het triethylamine vluchtig is, het ongeveer 89 ° C kookt, dankzij de relatief grote moleculaire massa.
Eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof met onaangename geur van ammoniak en vis.
Molaire massa
101,193 g/mol.
Kookpunt
89ºC.
Smeltpunt
-115ºC. Merk op hoe zwak de intermoleculaire krachten die de triethylaminemoleculen in hun vaste stof verenigen.
Dikte
0,7255 g/ml.
Oplosbaarheid
Het is relatief oplosbaar in water, 5,5 g/100 g bij 20 ° C. Onder 18,7 ºC, volgens PubChem is het hiermee zelfs mengbaar.
Naast het "opschieten" met water, is het ook oplosbaar in aceton, benzeen, ethanol, ether en paraffine.
Dampdichtheid
3.49 met betrekking tot lucht.
Dampdruk
57.07 mmHg bij 25 ° C.
Henry Constant
66 μmol/pa · kg.
ontstekingspunt
-15ºC.
Zelf -richtingtemperatuur
312ºC.
Warmte capaciteit
216.43 kJ/mol.
Verbranding warmte
10.248 limoen/g.
Verdampingswarmte
34.84 kJ/mol.
Oppervlaktespanning
20.22 N/M A 25ºC.
Brekingsindex
1.400 tot 20ºC.
Smurrie
0,347 MPa · s bij 25 ° C.
Basiciteit constant
Trietilamine heeft een PKB gelijk aan 3,25.
Basiciteit
De basiciteit voor dit amine kan worden uitgedrukt door de volgende chemische vergelijking:
Kan u van dienst zijn: synthetische polymerenNetto3 + Ha nhet3+ + NAAR-
Waar is het een zwakke zuursoort. Het Nhet -paar3+NAAR- Het vormt wat een tertiair ammoniumzout wordt.
Nhet conjugaatzuur3+ Het is stabieler dan ammonium, NH4+, Omdat de drie ethylgroepen een deel van hun elektronische dichtheid doneren om de positieve belasting op het stikstofatoom te verminderen; Daarom is triethylamine eenvoudiger dan ammoniak (maar minder eenvoudig dan OH-)).
Toepassingen
 Reacties gekatalyseerd door triethylamine. Bron: Tachymètre [Public Domain].
Reacties gekatalyseerd door triethylamine. Bron: Tachymètre [Public Domain]. Basisiteit, in dit geval, wordt de nucleofiliciteit van triethylamine gebruikt om de synthese van ester en amiden uit een gemeenschappelijk substraat te katalyseren: een acylchloride, rcocl (superieur beeld).
Hier valt de stikstofelektronen vrije paar de carbonylgroep aan en vormt een tussenpersoon; die, opeenvolgend, wordt aangevallen door een alcohol of een amine om respectievelijk een ester of amida te vormen.
In de eerste rij van het beeld wordt het mechanisme dat de reactie volgt om de ester te produceren, gevisualiseerd, terwijl de tweede rij overeenkomt met de amida. Merk op dat in beide reacties triethylamine hydrochloride optreedt, net3· HCl, van waaruit de katalysator wordt hersteld om een andere cyclus te starten.
Polymeren
De nucleofiliciteit van triethylamine wordt ook gebruikt om bepaalde polymeren toe te voegen, te genezen en ze grotere massa's te geven. Het maakt bijvoorbeeld deel uit van de synthese van polycarbonated harsen, polyurethaanschuim en epoxyharsen.
Chromatografie
Door zijn externe amfifiliciteit en volatiliteit kunnen zijn afgeleide zouten worden gebruikt als reagentia in ionenuitwisselingchromatografie. Een ander impliciet gebruik van triethylemine is dat er verschillende zouten van tertiaire amines kunnen worden verkregen, zoals triethylamine bicarbonaat, nhet3HCO3 (of Teab).
Kan u van dienst zijn: calorimetrie: welke studies en toepassingenCommerciële producten
Het is gebruikt als een additief bij de formulering van sigaretten en tabak, voedselconserveermiddelen, vloeren, smaakstoffen, pesticiden, kleurstoffen, enz.
Risico's
De dampen van triethylamine zijn niet alleen onaangenaam, maar ook gevaarlijk, omdat ze de neus, keel en longen kunnen irriteren om longoedeem of bronchitis te veroorzaken. Evenzo, omdat ze dichter en zwaar zijn dan de lucht, blijven ze op de grondniveau en gaan ze naar mogelijke warmtebronnen om vervolgens te exploderen.
De containers van deze vloeistof moeten zo ver van vuur zijn omdat ze een dreigend gevaar van explosie vertegenwoordigen.
Bovendien is contact met soorten of reagentia zoals: alkalinemetalen, tricloorazijnzuur, nitraten, salpeterzuur (omdat het nitrosoamines, carcinogene verbindingen zou vormen), sterke zuren, peroxiden en permanganaten.
Je moet aluminium, koper, zink of zijn legeringen niet aanraken, omdat het de mogelijkheid heeft om ze te corroderen.
Wat fysiek contact betreft, kan het allergie en huiduitslag veroorzaken als de blootstelling acuut is. Naast de longen kan het de lever en de nieren beïnvloeden. En met betrekking tot oculair contact veroorzaakt het irritatie, die zelfs de ogen kan beschadigen als ze niet in de tijd worden behandeld of gereinigd.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Wikipedia. (2019). Triethylamine. Opgehaald uit: in.Wikipedia.borg
- Merken. (2019). Triethylamine. Hersteld van: Sigmaaldrich.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Triethylamine. PubChem -database. CID = 8471. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Gegevensnetwerk voor toxicologie. (S.F.)). Triethylamine. Hersteld van: toxnet.NLM.NIH.Gov
- New Jersey Department of Health. (2010). Triethylamine. Hersteld van: nj.Gov
- « 10 curiosa over de middeleeuwen die je zullen verrassen
- Isoamilico alcoholische structuur, eigenschappen, gebruik en risico's »

