Vertakking van alkanen
- 4104
- 199
- Pete Heaney V
 Gekramde alkanen zijn koolstof- en waterstofverbindingen verenigd door eenvoudige koolstof-koolstof- en koolstofhydrogene bindingen. Bron: Nilo Robles, Public Domain, via Wikimedia Commons
Gekramde alkanen zijn koolstof- en waterstofverbindingen verenigd door eenvoudige koolstof-koolstof- en koolstofhydrogene bindingen. Bron: Nilo Robles, Public Domain, via Wikimedia Commons Wat zijn de vertakte alkalen?
De Vertakking van alkanen Het zijn verzadigde koolwaterstoffen waarvan de structuren niet bestaan uit een lineaire ketting. Het zijn alkanen met alkylgroepen verenigd in de centrale koolstofketen. Ze bevatten alleen koolstof- en waterstofatomen, verenigd door eenvoudige koolstof-koolstof- of koolstofhydrogene bindingen. De moleculen hebben gevolgen en zijn daarom niet lineair.
De alkanen van lineaire ketens worden onderscheiden van hun vertakte isomeren door een brief toe te voegen N Voorafgaand aan de naam. Aldus betekent het N-hexaan dat de structuur bestaat uit zes koolstofatomen die in een keten zijn uitgelijnd.
De takken van een grimmig glas van een boom kunnen worden vergeleken met die van de vertakte alkalen; De dikte van hun ketens, nu hoofd, secundair of tertiair, heeft echter allemaal dezelfde dimensies. Dit komt omdat in alle eenvoudige C-C-links aanwezig zijn.
Naarmate ze groeien, hebben bomen de neiging om te vertakken; Op dezelfde manier als de alkanes doen. Houd een constante ketting bij met bepaalde methyleeneenheden (-CH2-) impliceert een reeks energiecondities. Hoe meer energie de alkaos hebben, hoe groter de neiging om te vertakken.
Zowel lineaire als vertakte isomeren delen dezelfde chemische eigenschappen, maar met kleine verschillen in hun kookpunten, fusie en andere fysische eigenschappen. Een voorbeeld van vertakte alkaan is de 2-methyl-professionele, de eenvoudigste van allemaal.
Chemische structuren van vertakte alkalen
Vertraagde en lineaire alkanen hebben dezelfde algemene chemische formule: cNH2n+2. Dat wil zeggen beide, voor een bepaald aantal koolstofatomen, hebben ze hetzelfde aantal hydrogenen. Daarom zijn de twee soorten verbindingen isomeren: ze hebben dezelfde formule maar verschillende chemische structuren.
Kan u van dienst zijn: beryllium: geschiedenis, structuur, eigenschappen, gebruikWat wordt voor het eerst waargenomen in een lineaire ketting? Een eindig aantal methyleengroepen, -CH2-. Dus cho3Ch2Ch2Ch2Ch2Ch2Ch3 Het is een lineaire keten alkaan genaamd n-heptano.
Let op de vijf opeenvolgende methyleengroepen. Ook moet worden opgemerkt dat deze groepen alle ketens vormen en daarom van dezelfde dikte zijn, maar met variabele lengtes. Wat kan er nog meer over hen worden gezegd? Die 2e koolstofatomen zijn, dat wil zeggen koolstofatomen gekoppeld aan twee andere.
Zodat deze N-Heptano is vertrapt, is het noodzakelijk om achter te komen. Als? De mechanismen kunnen zeer complex zijn en impliceren de migratie van atomen en de vorming van positieve soorten die bekend staan als carbocaties (-c+)).
Op papier is het echter voldoende om de structuur zodanig te bestellen dat er 3e en 4e koolstofatomen zijn; Met andere woorden, koolstofatomen gekoppeld aan drie of vier. Deze nieuwe bestelling is stabieler dan lange groepsgroepen2 Omdat de 3e en 4e koolstofatomen energetisch stabieler zijn.
Chemische en fysische eigenschappen van vertakte alkalen
De vertakte en lineaire alkanen, met dezelfde atomen, behouden dezelfde chemische eigenschappen. Hun links blijven eenvoudig, C-H en C-C, en met weinig elektronegativiteiten verschil, dus hun moleculen zijn apolair. Het hierboven genoemde verschil ligt in de 3e en 4e koolstofatomen (Chr3 en Cr4)).
Wanneer de ketting echter in de isomeren wordt vertakt, verandert deze de manier waarop moleculen met elkaar omgaan.
De manier om twee lineaire takken van een boom te krijgen, is bijvoorbeeld niet gelijk aan het plaatsen van twee sterk vertakte één op de andere. In de eerste situatie is er veel oppervlakkig contact, terwijl in de tweede de "gaten" tussen de takken overheersen. Sommige vertakkingen werken meer op met anderen dan met de hoofdtak.
Kan u van dienst zijn: nepelometrieDit alles leidt tot vergelijkbare, maar niet gelijke waarden in veel van de fysieke eigenschappen.
Kook- en fusiepunten
De vloeibare en vaste fasen van de alkanen zijn onderworpen aan de intermoleculaire krachten onder specifieke drukomstandigheden en temperatuur. Omdat de moleculen van de vertakte en lineaire alkanen niet op dezelfde manier interageren, zullen hun vloeistoffen of vaste stoffen niet hetzelfde zijn.
Fusie- en kookpunten nemen toe met het aantal koolstofatomen. Voor lineaire alkanen zijn deze evenredig met N. Maar voor de vertakte alkanen hangt de situatie af van hoe vertakt de hoofdketen is, en wat zijn de substituent of alquilicale groepen (R).
Als de lineaire ketens worden beschouwd als rijen zigzags, kunnen ze perfect over elkaar passen; Maar met de takken werken de hoofdketens bijna niet op omdat de substituenten ze bij elkaar afhouden.
Als gevolg hiervan hebben vertakte alkanen een lager moleculair contactoppervlak en daarom zijn hun fusie- en kookpunten meestal een beetje klein. Hoe meer vertakt de structuur, minderjarigen zullen nog steeds deze waarden zijn.
Bijvoorbeeld de n-pentano (ch3Ch2Ch2Ch2Ch3) heeft een 36 peb.1 ° C, terwijl het 2-methyl-butane (kies3Ch2(Ch3) Ch2Ch3) en de 2.2-dimethyl-professionele (C (CH (Kies3))4) van 27.8 en 9.5 ° C.
Dikte
Met dezelfde redenering zijn de vertakte alkanen iets minder dicht, omdat ze een groter volume bezetten, product van de afdaling van het oppervlaktecontact tussen de hoofdketens.
Net als lineaire alkanen, zijn ze niet -mengbaar met water en drijven er overheen; dat wil zeggen, ze zijn minder dicht.
Kan u van dienst zijn: de 7 belangrijkste biochemie -toepassingenNomenclatuur en voorbeelden
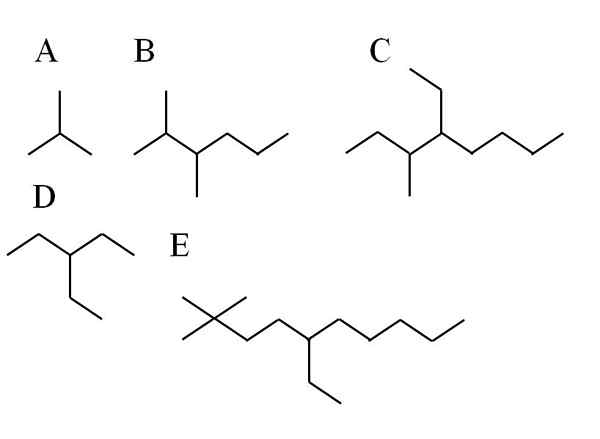
 Voorbeelden van vertakte alkanen. Bron: Gabriel Bolívar
Voorbeelden van vertakte alkanen. Bron: Gabriel Bolívar In de bovenste afbeelding worden vijf voorbeelden van vertakte alkalen getoond. Merk op dat gevolgen worden gekenmerkt door 3e of 4e koolstofatomen. Maar wat is de hoofdketen? Dat met het grootste aantal koolstofatomen.
- In a is het onverschillig, omdat ongeacht welke keten het is gekozen, beide 3 c hebben. Dan is zijn naam 2-methyl-professioneel. Het is butane isomeer, c4H10.
- Alcano B heeft op het eerste gezicht twee substituenten en een lange ketting. Aan de groepen -CH3 Ze worden zodanig vermeld dat ze het minste nummer hebben; Daarom beginnen koolstoffen aan de linkerkant te tellen. Aldus wordt B 2,3-dimethyl-hexaan genoemd.
- Voor C is hetzelfde van toepassing als in B. De hoofdketen heeft 8 ° C en de twee substituenten, een cho3 en een CH2Ch3 Ze zijn meer aan de linkerkant. Zijn naam is daarom: 4-ethyl-3-methylocthaan. Merk op dat de substituent -etil vóór de -methyl wordt vermeld door zijn alfabetische volgorde.
- In het geval van D is het onverschillig wanneer de koolstoffen van de hoofdketen beginnen te tellen. Zijn naam is: 3-ethyl-propane.
- En ten slotte voor E, een iets complexere vertakte alkaan, is de hoofdketen 10 ° C en begint het bij een van de CH -groepen3 van links. Op deze manier is zijn naam: 5-ethyl-2,2-dimethyl-decano.
Referenties
- Carey, f. NAAR. (2006). Organische chemie zesde editie. Mc Graw Hill Editorial, pagina's 74-81.
- John T. Moore, Chris Hren, Peter J. Mikulecky. Hoe u vertakte alkanen in de chemie kunt noemen. Hersteld van: dummies.com
- Dr. Ian Hunt. (2014). Eenvoudige vertakte alkanen. Genomen uit: chem.Ucalgary.AC
- Helmestine, Anne Marie, pH.D. (8 januari 2018). Vertakte ketting alkane definitie. Hersteld van: Thoughtco.com
- Chemistry Libhethexts. Vertakte keten alkanes. Genomen uit: chem.Librhetxts.borg
- Faceles: structuur en eigenschappen. Genomen uit: uam.is
- Nomenclatuur: Alceans. [PDF]. Genomen van: chemie.Jij.Edu.co

