Lineaire Alcanos -structuur, eigenschappen, nomenclatuur, voorbeelden

- 4961
- 966
- Ernesto McKenzie
De Lineaire alkanen Het zijn verzadigde koolwaterstoffen waarvan de algemene chemische formule is N-CNH2n+2. Omdat ze verzadigde koolwaterstoffen zijn, zijn al zijn bindingen eenvoudig (C-H) en zijn ze alleen samengesteld uit koolstof- en waterstofatomen. Ze ontvangen ook de naam van paraffines, die hen onderscheiden van de vertakte toums waaraan ze isoparafinas worden genoemd.
Deze koolwaterstoffen missen gevolgen en ringen. Meer dan lijnen lijken deze familie van organische verbindingen meer op ketens (rechte keten alkane); of vanuit een culinaire hoek tot spaghettis (rauw en gekookt).
 Als de rauwe spaghetti minder bros zou zijn, zouden ze een nog nauwere overeenkomst hebben met lineaire alkanen. Bron: Pixabay.
Als de rauwe spaghetti minder bros zou zijn, zouden ze een nog nauwere overeenkomst hebben met lineaire alkanen. Bron: Pixabay. De ruwe spaghetti komt het ideale en geïsoleerde staat van lineaire alkanen weer, hoewel met een uitgesproken neiging om te breken; Terwijl de gekookte, ongeacht of ze hun natuurlijke en synergetische toestand naderen of niet: sommige interageren met anderen in een geheel (bijvoorbeeld het pastagerecht).
Dit soort koolwaterstoffen worden van nature aangetroffen in aardgas- en olieafzettingen. De lichtste hebben smeerkenmerken, terwijl zware zich gedragen als een ongewenst asfalt; Oplosbaar echter in paraffins. Ze serveren zeer goed als oplosmiddelen, smeermiddelen, brandstoffen en asfalt.
[TOC]
Structuur van lineaire alkanen
Groepen
Er werd vermeld dat de algemene formule van deze alkanen C isNH2n+2. Deze formule is in feite hetzelfde voor alle alkanen, lineair of vertakt. Het verschil dan in de N- Dat gaat vooraf aan de Alcano -formule, wiens aanduiding "normaal" betekent.
Het zal later dan dit te zien zijn N- Het is niet nodig voor alkanen met een koolstofnummer gelijk aan of minder dan vier (n ≤ 4).
Een lijn of ketting kan niet bestaan uit een enkel koolstofatoom, dus methaan wordt uitgesloten voor uitleg (CH4, n = 1). Als n = 2, hebben we het ethaan, cho3-Ch3. Merk op dat deze alkaan bestaat uit twee methylgroepen, cho3, aan elkaar gekoppeld.
Het aantal koolstofatomen, n = 3, het alkaanpropaan verhogen, wordt verkregen, cho3-Ch2-Ch3. Nu verschijnt er een nieuwe groep, Cho2, methyleen genoemd. Het maakt niet uit hoe groot de lineaire alkane is, je zult altijd twee groepen hebben, niets meer: cho3 en ch2.
Kan u van dienst zijn: iterbio: structuur, eigenschappen, gebruik, verkrijgenLengtes van hun ketens
Wanneer het aantal koolstofatomen van de lineaire alkaan toeneemt, is er een constante in alle resulterende structuren: het aantal methyleengroepen is verhoogd. Stel bijvoorbeeld dat lineaire alkanen met n = 4, 5 en 6:
Ch3-Ch2-Ch2-Ch3 ((N-butaan)
Ch3-Ch2-Ch2-Ch2-Ch3 ((N-Pentano)
Ch3-Ch2-Ch2-Ch2-Ch2-Ch3 ((N-hexaan)
De ketens worden langer omdat ze toevoegen aan hun structurengroepencholes2. Aldus verschilt een uitgebreide of korte lineaire alkaan in hoeveel cho2 scheidt de twee terminale groepen CH3. Al deze alkanen hebben niets plus twee deze3: Aan het begin van de ketting en aan het einde van hetzelfde. Als ik meer had, zou dit de aanwezigheid van gevolgen impliceren.
Evenzo is de totale afwezigheid van CH -groepen te zien, alleen aanwezig in de gevolgen of wanneer er substituentgroepen zijn gekoppeld aan een van de koolstofatomen van de ketting.
De structurele formule kan als volgt worden samengevat: CH3(Ch2))N-2Ch3. Probeer het toe te passen en te illustreren.
Conformaties
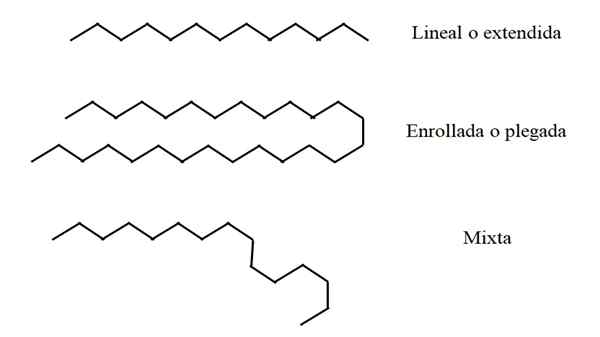 Structurele conformaties van lineaire alkanen. Bron: Gabriel Bolívar.
Structurele conformaties van lineaire alkanen. Bron: Gabriel Bolívar. Sommige lineaire alkanen kunnen langer of korter zijn dan andere. Aldus kan n een waarde van 2 tot ∞ hebben; dat wil zeggen, een oneindige CH -groepen met elkaar2 en twee CH -groepen3 terminals (in theorie is mogelijk). Niet alle ketens "accommoderen" echter op dezelfde manier in de ruimte.
Hier ontstaan de structurele conformaties van alkanen. Wat ze verschuldigd zijn? Naar de roteerbaarheid van de C-H-links en de flexibiliteit daarvan. Wanneer deze links draaien of rotten.
Lineair
In de bovenste afbeelding wordt bijvoorbeeld een keten van dertien koolstofatomen die lineair of verlengd blijven, in het hoogste deel weergegeven. Deze conformatie is ideaal, omdat wordt aangenomen dat de moleculaire omgeving de ruimtelijke beschikking van de ketenatomen minimaliseert. Niets stoort haar en hoeft niet te buigen.
Het kan u van dienst zijn: propyleenglycol: structuur, eigenschappen, synthese en gebruikGerold of gevouwen
In het midden van het beeld ervaart de zevenentwintig koolstofketen een externe verstoring. De structuur, om "comfortabeler" te zijn, roteert zijn links zodanig dat het op zichzelf vouwt; Net als een lange spaghetti.
Computationele studies toonden aan dat het maximale aantal koolstofatomen dat een lineaire keten kan hebben, n = 17 is. Van n = 18 is het onmogelijk voor hem om niet te worden opgevouwen of gerold.
Gemengd
Als de ketting erg lang is, kunnen er regio's zijn die lineair blijven, terwijl anderen zijn gebogen of ingeschreven. Van alles is dit misschien de conformatie die het dichtst bij de realiteit ligt.
Eigenschappen
Fysiek
Als koolwaterstoffen zijn ze in apolaire essentie en daarom hydrofoob. Dit betekent dat ze niet met water kunnen worden gemengd. Ze zijn weinig dicht omdat hun ketens te veel lege ruimtes tussen hen achterlaten.
Ook variëren hun fysieke toestanden van frisdrank (voor n < 5), líquidos (para n < 13) o sólidos (para n ≥ 14), y dependen de la longitud de la cadena.
Interacties
De moleculen van de lineaire alkanen zijn apolair, en daarom zijn hun intermoleculaire krachten van het dispersietype Londen. De ketens (waarschijnlijk een gemengde conformatie aannemen), worden vervolgens aangetrokken door de werking van hun moleculaire massa's en de instant geïnduceerde dipolen van hun waterstof- en koolstofatomen.
Het is om deze reden dat wanneer de ketting langer wordt en daarom zwaarder, zijn kookpunten en fusie op dezelfde manier toeneemt.
Stabiliteit
Hoe langer de ketting, hoe onstabieler het is. Meestal lijden ze scheuren van hun banden om kleinere ketens van een grote te veroorzaken. In feite staat dit proces bekend als Craqueo, Sterk gebruikt bij olieraffinage.
Nomenclatuur
Om de lineaire alkanen te noemen, is het voldoende om de N-indicator voor de naam toe te voegen. Als n = 3, zoals het geval is bij propaan, is het onmogelijk voor deze alkane om een tak te presenteren:
Kan u van dienst zijn: anorganische verbindingenCh3-Ch2-Ch3
Ding dat niet gebeurt van n = 4, dat wil zeggen, met de N-blutane en de andere alkanen:
Ch3-Ch2-Ch2-Ch3
OF
(Ch3))2CH-CH3
De tweede structuur komt overeen met het isobutaan, dat bestaat uit een structureel isomeer van de butane. Om de ene van de andere te onderscheiden, komt indicator n in het spel-. Dus de N-Butano verwijst alleen naar het lineaire isomeer, zonder vertakkingen.
Hoe groter de n, hoe groter het aantal structurele isomeren en het grootste belang zal N- moeten gebruiken om naar de lineaire isomeer te verwijzen.
Bijvoorbeeld de octaan, c8H18 (C8H8 × 2 + 2), presenteert tot dertien structurele isomeren, omdat veel gevolgen mogelijk zijn. De lineaire isomeer is echter genoemd: N-octaan, en de structuur is:
Ch3-Ch2-Ch2-Ch2-Ch2-Ch2-Ch2-Ch3
Voorbeelden
Ze worden hieronder genoemd en om een aantal lineaire alkanen te beëindigen:
-Etano (c2H6): Ch3Ch3
-Propaan (c3H8): Ch3Ch2Ch3
-N-Heptano (c7H16): Ch3(Ch2))5Ch3.
- N-Dean (C10H22): Ch3(Ch2))8Ch3.
-N-Hexadecano (c16H3. 4): Ch3(Ch2))14Ch3.
-N-Non Adecano (C19H40): Ch3(Ch2))17Ch3.
-N-Eicosan (ctwintigH42): Ch3(Ch2))18Ch3.
- N-Hectane (c100H202): Ch3(Ch2))98Ch3.
Referenties
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. (5e editie). Redactionele addison-wesley inter-Amerikaan.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Jonathan M. Goede man. (1997). Wat is de lange onvertakte alkane met lineaire globale minimale conformatie? J. Chem. Inferen. Berekenen. Sci. 1997, 37, 5, 876-878.
- García Nissa. (2019). Wat zijn alkanes? Studie. Hersteld van: studie.com
- Dhr. Kevin A. Boudaux. (2019). Alkanes. Hersteld van: Angelo.Edu
- Lijst met rechte keten alkenes. [PDF]. Hersteld van: Laney.Edu
- Helmestine, Anne Marie, pH.D. (7 september 2018). Noem de eerste 10 alkanes. Hersteld van: Thoughtco.com
- Eigenzinnige wetenschap. (20 maart 2013). Rechte keten alkanen: het voorspellen van eigenschappen. Hersteld van: Quirkyscience.com
- Wikipedia. (2019). Hogere alkanen. Opgehaald uit: in.Wikipedia.borg
- « Afgeleid van cotangente berekening, demonstratie, oefeningen
- Cyclopentanoperhydofenantreno -structuur en belang »

