Acetylcholinesterase -structuur, functies en remmers
- 5174
- 820
- Ernesto McKenzie
De acetylcholinesterase (Acetylcholine acetylsa Hydrolese, EC 3.1.1.7) Het is een enzym dat voornamelijk in het centrale zenuwstelsel ligt. Zijn taak, zoals de naam al aangeeft, is de hydrolytische verwerking van de acetylcholine -neurotransmitter.
Het is een enzym geassocieerd met het celmembraan dat samenwerkt met de acetylcholine -ontvanger om de excitatie van postsynaptische cellen te bemiddelen en waarvan het katalytisch mechanisme verrassend snel is.
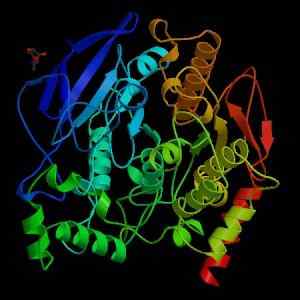
 Acetylcholinesterase -structuur (Bron: Wikimedia Commons)
Acetylcholinesterase -structuur (Bron: Wikimedia Commons) Vanuit mechanisch oogpunt kan dit enzym worden gezien als een serin-hydrolase, en in het katalytische domein van zijn actieve plaats bevat het de triade van aminozuren die kenmerkend zijn voor de proteasen: serine, histidine en een zuurresidu. Het zure residu is echter een glutamaat, terwijl proteasen normaal gesproken een aspartaat hebben.
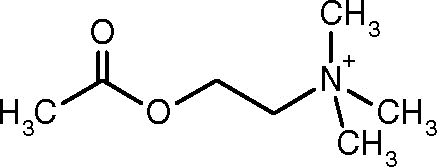 Acetylcholinestructuur (Bron: Alinebloom [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Acetylcholinestructuur (Bron: Alinebloom [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Een van de eerste waarnemingen die de katalytische activiteit van acetylcholinesterase verbond met cholinerge zenuwweefsels en spierweefsels was die van Dale in 1914; Vervolgens is vastgesteld dat het ook aanwezig is in niet-collorische neuronen en in hematopoietische, osteogene en neoplastische cellen.
Dankzij de studie van verschillende organismen is het momenteel bekend dat enzym aanwezig is in het membraan van verschillende soorten cellen zoals erytrocyten, zenuw- en spiercellen, elektrische organen en andere.
[TOC]
Structuur
Tertiaire en quaternaire structuur
In natuurlijke omstandigheden of "in vivo ", Acetylcholinesterase is een polymorf enzym dat bestaat uit verschillende katalytische subeenheden van min of meer 80 kDa, die worden geassembleerd om een oligomere structuur te vormen (van verschillende subeenheden).
De hoeveelheid en complexiteit van deze subeenheden hangt af van het celtype en de soorten die worden overwogen.
Sommige van de meest complexe enzymatische vormen hebben katalytische subeenheden met bolvormige vormen (g) of asymmetrische (a) gekoppeld door disulfidebruggen. De disulfidebruggen zijn covalente bindingen gevormd tussen twee zwavelmoleculen van de tiolgroepen (-sh) van twee residuen van de cysteïnecodezuur.
Elke subunidad G bevat een enkele actieve site, terwijl subeenheden A meestal worden gekenmerkt door drie structurele domeinen te presenteren, namelijk: katalytische subeenheden, collageenstaarten die rijk zijn aan glycine, hydroxiproline en hydroxilisine afval en anderen niet-collagene staarten (verschillend van collageen) (verschillend van collageen).
Asymmetrische vormen van acetylcholinesterase staan bekend als A12, A8 en A4, die respectievelijk 12, 8 en 4 katalytische subeenheden hebben.
Kan u van dienst zijn: Flora en Fauna uit Afrika: Representatieve soortenOver het algemeen bevinden de residuen van het katalytische domein in de actieve plaats zich in een "diep" gebied van de subeenheden, dat kan worden beschouwd als tegenstrijdig met betrekking tot de snelle snelheid van de reactie die dit enzym en de schijnbare ontoegankelijkheid van het substraat tot deze sites.
Ongeacht het enzympolymorfisme, zowel bolvormige als asymmetrische subeenheden hebben vergelijkbare katalytische activiteiten.
Varianten
Sommige andere cellen dan zenuwcellen, omdat erytrocyten overwegend boletrische, dimetrische en meestal geassocieerde acetylcholineste enzymen produceren met het buitenste gezicht van het plasmamembraan.
Het enzym van erytrocyten, hoewel van minder structurele complexiteit, is ook een amfipatisch enzym, waarvan de actieve katalytische domein wordt gevonden in het grote hydrofiele gebied, terwijl hydrofoob domein, dat het terminale carboxylgebied bevat, verantwoordelijk is voor het in stand houden van het in het membraan.
Primaire structuur
Veel van de huidige kennis over de sequentie van acetylcholinesterase kwam voort uit de studie van het enzym van Californica Torpedo, Een lijnvissen die in de Stille Oceaan leeft en die traditioneel wordt gebruikt als een modelorganisme voor de studie van verschillende eiwitten van het zenuwstelsel.
De subeenheden van acetylcholinesterase worden gesynthetiseerd als pro-eiwitten die vervolgens worden verwerkt om aanleiding te geven tot rijpe subeenheden. Elke subeenheid bestaat uit een polypeptide van ongeveer 575 aminozuren en 65 kDa molecuulgewicht, wat toeneemt door de toevoeging van 7-8% koolhydraatafval (glycosylatie).
De katalytische activiteit van de actieve plaats van de subeenheden wordt bepaald door een serineresten in de 200 positie, dat zich in een "diep" gebied van de katalytische subeenheden bevindt.
Verschillende varianten of isovormen van het enzym bestaan in organismen dankzij verschillende plaatsen voor de "alternatieve splicing " van de pre-arren boodschappers aan beide uiteinden (5 'en 3'). De carboxyl-terminale sequentie van de isovorm van elke subeenheid is degene die de assemblage van de oligomeren met elkaar bepaalt.
Functie
Acetylcholinesterase is een enzym met meerdere biologische functies die niet noodzakelijkerwijs aan elkaar gerelateerd zijn. Actuest gemaakt door zijn differentiële expressie tijdens embryogenese, embryonale neurale extensie, spierontwikkeling en syntogenese.
Zoals eerder benadrukt, heeft het een belangrijke functie bij snelle hydrolyse van acetylcholine en daarom in de regulatie van het effect ervan op de neuromusculaire synaptische ruimte of in de collorische synaptische ruimtes van het centrale zenuwstelsel van het centrale zenuwstelsel van het centrale zenuwstelsel.
Het kan u van dienst zijn: biologietoepassingen in veeEen voorbeeld van zijn functies is de samentrekking van skeletspier, die optreedt dankzij een soort chemische synaps die bekend staat als motorische plaque, gelegen tussen een motorneuron en een spiervezel.
In deze synaps worden honderden blaasjes geladen met acetylcholine bereikt, die uit het motorneuron worden vrijgegeven voor de verspreiding van een elektrische impuls.
Dit neurotransmissieproces is vrij complex, maar de deelname van acetylcholinesterase is cruciaal voor de beëindiging van synaptische transmissie die afhankelijk is van de acetylcholine neurotransmitter, omdat het moet worden afgebroken en vervolgens buiten de synaptische gespleten te compleeten met de membraan -opwinding.
Aldus is het acetylcholinesterase -enzym verantwoordelijk voor het reguleren van de concentratie van deze zender in de neuromotora -synaps.
Andere "niet -klassieke" functies van het enzym zijn gerelateerd aan neuritogenese of groei van zenuwcellen; Met celadhesieprocessen, synaptogenese, activering van neuronen-dopamine in de zwarte substantie van de middenhersenen, hematopoietische processen en trombus poëtisch, onder anderen.
Remmers
Acetylcholinesteraseremmers werken dat wordt gehydrolyseerd tot acetylcholine, waardoor het niveau en de duur van de werking van deze neurotransmitter wordt verhoogd. Ze kunnen worden geclassificeerd, volgens hun werkingsmechanisme, als omkeerbaar en onomkeerbaar.
Onomkeerbare remmers
Zij zijn degenen die de hydrolytische activiteit van acetylcholinesterase onomkeerbaar remmen vanwege hun covalente junctie met het serineresten op de actieve plaats van het enzym. Deze groep bestaat voornamelijk uit organofosfaat.
Over het algemeen zijn dit actieve verbindingen aanwezig in veel insecticiden en zijn ze verantwoordelijk voor een groot aantal toevallige sterfgevallen als gevolg van vergiftiging. Het zijn esters of thiolen afgeleid van fosforische, fosfonische, fosfine of fosforamídicozuur.
Sarin, Tabun, Soman en cyclosarine behoren tot de meest giftige verbindingen die door de mens zijn gesynthetiseerd, omdat ze een mens kunnen doden door ademhalings- en bloedsomloop te induceren als gevolg van acetylcholinesterase -blokkade in het perifere zenuwstelsel.
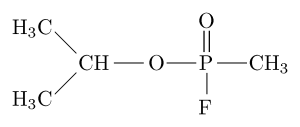 Moleculaire structuur van de organofosfaatremmer "Sarín" (Bron: Sivizius [Public Domain] via Wikimedia Commons)
Moleculaire structuur van de organofosfaatremmer "Sarín" (Bron: Sivizius [Public Domain] via Wikimedia Commons) Sarin is bijvoorbeeld een "nerveus gas" dat is gebruikt als een chemisch wapen voor terroristengebruik.
Omkeerbare remmers
Deze volgorde van de classificatiegroepen concurrerende en niet -competitieve remmers die werken door voorbijgaande en omkeerbare carbamylering van een serineresten op de actieve site en velen zijn gesynthetiseerd en gezuiverd uit planten- of schimmelbronnen.
Kan u van dienst zijn: SOKES: Kenmerken, structuur, functiesCarbamaten zoals fysostigmine en neostigmine zijn omkeerbare remmers die worden gebruikt als medicijnen voor de behandeling van ziekten zoals glaucoom en miastenia Gravis, respectievelijk.
Andere therapeutische middelen van deze groep worden ook gebruikt voor de behandeling van de ziekte van Alzheimer, Parkinson's Parkinson, post-operatieve darmobstructies (postoperatieve ileus), uitzetting van de blaas en als antidotes voor overdosis met anticholinergica.
Butirilcolinesterase
Een interessant natuurlijk mechanisme tegen sommige remmende stoffen van acetylcholinesterase heeft te maken met de deelname van een minder specifiek enzym dat bekend staat als butirilcolinesterase.
Dit enzym kan ook hydrolyseren.
Acetylcholinesterase en de ziekte van Alzheimer
Er is aangetoond dat acetylcholinesterase een stabiel complex vormt met de componenten van de kenmerken van de senielen van de pathologie. Bovendien zijn enkele veranderde patronen van glycosylering van dit enzym gerelateerd aan de aanwezigheid en vorming van amyloïde plaques in de hersenen.
Veel van de omkeerbare remmers van acetylcholinesterase zijn daarom gebruikt als geneesmiddelen in de eerste generatie voor de behandeling van deze ziekte en andere gerelateerde neurodegeneratieve aandoeningen. Onder hen zijn Donepezilo, Rivastigmina en Galantamine.
Referenties
- Dvir, h., Silman, ik., Harel, m., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesterase: van 3D -structuur tot functie. Chemische biologische interacties, 187, 10-22.
- Houghton, p., Ren, en., & Howes, m. (2006). Acetylcholinesteraseremmers van planten en schimmels. Natuurlijke productrapporten, 23, 181-199.
- Krsti, D. Z., Lazarevi, t. D., Bond, a. M., & Vasi, V. M. (2013). Acetylcholinesteraseremmers: farmacologie en toxicologie. Huidige neurofarmacy, elf, 315-335.
- Mukherjee, p. K., Kumar, V., Slecht, m., & Houchton, p. J. (2007). Acetylcholinesteraseremmers van planten. Fytomedicine, 14, 289-300.
- Quinn, D. M. (1987). Acetylcholinesterase: enzymstructuur, reactiedynamiek en virtuele overgangstoestanden. Chem. Revisie., 87, 955-979.
- Racchi, m., Mazzucchelli, m., Porrello, E., Lanni, C., & Govoni, s. (2004). Acetylcholinesteraseremmers: nieuwe activiteiten van oude molecles. Farmacologisch onderzoek, vijftig, 441-451.
- Rosenberry, T. (1975). Acetylcholinesterase. Vooruitgang in enzymologie en gerelateerde gebieden van moleculaire biologie, 43, 103-218.
- Soreq, h., & Seidman, s. (2001). Acetylcholinesterase - Nieuwe rollen voor een oude acteur. Natuurrecensies, 2, 294-302.
- Verhalen, v. N. (2001). Acetylcholinesterase bij de ziekte van Alzheimer. Mechanismen van veroudering en ontwikkeling, 122, 1961-1969.

