Absorptie wat is, voorbeelden en oefeningen opgelost
- 3930
- 747
- Irving McClure I
De absorptie Het is de logaritme met een negatief teken van het quotiënt tussen de opkomende lichtintensiteit en de lichte invallende intensiteit op een monster van doorschijnende oplossing die is verlicht met monochromatisch licht. Dit quotiënt is het uitzending.
Het fysieke proces van de doorgang van licht door een monster wordt genoemd lichtgevende transmissie, En absorptie is er een maat voor. Daarom wordt absorptie de minste logaritme van transmissie en is een belangrijk feit om de concentratie van een monster te bepalen dat in het algemeen opgelost is in een oplosmiddel zoals water, alcohol of een andere.
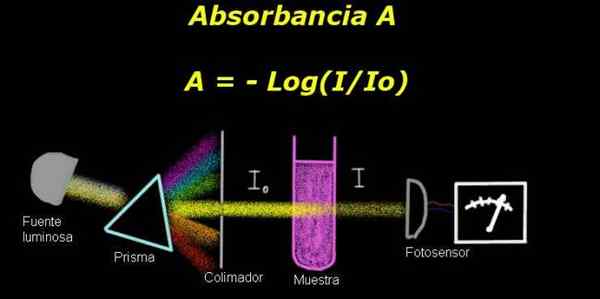
 Figuur 1. Schema van het absorptieproces. Bereid door f. Zapata
Figuur 1. Schema van het absorptieproces. Bereid door f. Zapata Om de absorptie te meten, is een apparaat vereist Elektro-fotomometer, waarmee een stroom wordt gemeten die evenredig is met de lichtintensiteit die op het oppervlak is incident.
Bij het berekenen van de transmissie wordt het signaal van de intensiteit die overeenkomt met alleen het oplosmiddel alleen gemeten en dit resultaat wordt geregistreerd als Io.
Vervolgens wordt het monster opgelost in het oplosmiddel met dezelfde verlichtingsomstandigheden geplaatst. De maatregel gemeten door de elektro-fotometer wordt aangeduid als Je, waarmee u de transmissie kunt berekenen T Volgens de volgende formule:
T = i / iof
Het is een ontketende hoeveelheid. De Absorptie a Dit wordt uitgedrukt als:
A = - log (t) = - log (i / iof))
[TOC]
Molaire absorptie en absorptie
De moleculen die een chemische stof vormen, kunnen licht absorberen, en een maat hiervan is precies absorptie. Het is het resultaat van de interactie tussen fotonen en moleculaire elektronen.
Daarom is het een grootte die zal afhangen van de dichtheid of concentratie van de moleculen die het monster vormen en ook van het optische pad of de afstand die door het licht wordt afgelegd.
U kunt u van dienst zijn: de derde wet van Newton: aanvragen, experimenten en oefeningenExperimentele gegevens geven aan dat absorptie NAAR is lineair evenredig met de concentratie C en afstand D Licht gereisd. Dus om het te berekenen op basis van deze parameters, kan de volgende formule worden vastgesteld:
A = ε⋅c⋅d
In de vorige formule, ε Het is een evenredigheidsconstante bekende onder de naam van Molair absorberend.
Molaire absorptiteit hangt af van het type substantie en golflengte waarmee absorptie wordt gemeten. De Molair absorberend Het is ook gevoelig voor de temperatuur van het monster en de pH van hetzelfde.
Bierlambertwet
Deze relatie tussen absorptie, absorptiteit, concentratie en afstand tot de dikte van het pad dat het licht in het monster volgt, staat bekend als bierlambertwet.
 Figuur 2. Bierwetgeving - Lambert. Bron: f. Zapata,
Figuur 2. Bierwetgeving - Lambert. Bron: f. Zapata, Hieronder zijn er enkele voorbeelden van hoe het te gebruiken.
Voorbeelden
voorbeeld 1
Tijdens een experiment een monster met een rood licht van een helium-neon laserlichten, waarvan de golflengte 633 nm is. Een elektro-fotometer meet 30 mV wanneer laserlicht direct beïnvloedt en 10 mV wanneer deze door een monster gaat.
In dit geval is de transmissie:
T = i / io = 10 mV / 30 mV = ⅓.
En de absorptie is:
A = - log (⅓) = log (3) = 0,48
Voorbeeld 2
Als dezelfde stof in de container wordt geplaatst met de helft van het dik.
Men moet worden overwogen dat als de dikte afneemt tot de helft, de absorptie die evenredig is met de optische dikte met de helft, dat wil zeggen a = 0,28. TON -transmissie zal worden gegeven door de volgende relatie:
Kan u van dienst zijn: verticale opname: formules, vergelijkingen, voorbeeldenT = 10-a = 10^(-0.28) = 0,53
De elektro-fotometer markeert 0,53*30 mV = 15,74 mV.
Opgeloste oefeningen
Oefening 1
Het is gewenst om de molaire absorptie van een bepaalde gepatenteerde verbinding te bepalen die in oplossing is. Hiervoor is de oplossing met licht van een natriumlamp van 589 nm verlicht. Het monster wordt op een 1,50 cm dik geplaatst.
Het is gebaseerd op een concentratieoplossing 4,00 × 10^-4 mol per liter en de transmissie wordt gemeten resulterend in 0,06. Bepaal met deze gegevens de molaire absorptie van het monster.
Oplossing
In de eerste plaats wordt de absorptie bepaald, die wordt gedefinieerd als de minst op logaritme gebaseerde tien van transmissie:
A = - log (t)
A = - log (0.06) = 1,22
Dan wordt de wet van Lambert-Beer gebruikt die een relatie tot stand brengt tussen absorptie, molaire absorptie, concentratie en optische lengte:
A = ε⋅c⋅d
Het opruimen van de molaire absorptiteit De volgende relatie wordt verkregen:
ε = a/(c⋅d)
De gegeven waarden vervangen:
ε = 1,22/(4,00 × 10^-4 m⋅1,5 cm) = 2030 (m⋅cm)^-1
Het vorige resultaat is afgerond op drie belangrijke cijfers.
Oefening 2
Om de nauwkeurigheid te verbeteren en de fout van de maat voor de molaire absorptie van het monster in Oefening 1 te bepalen, wordt het monster achtereenvolgens verdund in de helft van de concentratie en wordt de transmissie in elk geval gemeten.
Beginnend van CO = 4 × 10^-4 m met transmissie T = 0,06 De volgende gegevensvolgorde voor transmissie en absorptie berekend uit de transmissie wordt verkregen:
CO/1-> 0.06-> 1.22
CO/2-> 0.25-> 0.60
CO/4-> 0.50-> 0.30
CO/8-> 0.71-> 0.15
CO/16-> 0.83-> 0.08
CO/32-> 0.93-> 0.03
CO/64-> 0.95-> 0.02
CO/128-> 0.98-> 0.01
CO/256-> 0.99-> 0.00
Doe met deze gegevens:
Het kan u van dienst zijn: stationaire golven: formules, kenmerken, typen, voorbeeldena) Een grafiek van absorptie op basis van concentratie.
b) Een lineaire aanpassing van de gegevens en vind de helling.
c) Bereken uit de verkregen helling de molaire absorptie.
Oplossing
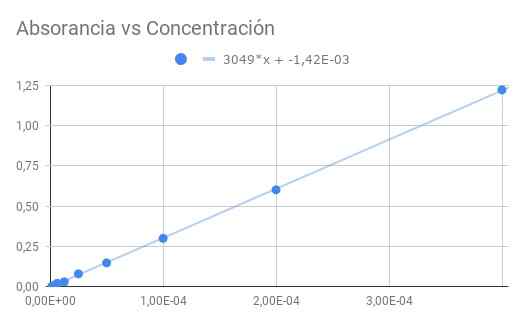 figuur 3. Absorptie versus concentratie. Bron: f. Zapata.
figuur 3. Absorptie versus concentratie. Bron: f. Zapata. De verkregen helling is het product van molaire absorganiviteit door de optische afstand, dus het verdelen van de helling op lengte 1,5 cm We worden molair absorberend
ε = 3049/1.50 = 2033 (m⋅cm)^-1
Oefening 3
Met de gegevens van Oefening 2:
a) Bereken de absorganiviteit voor elke gegevens.
b) Bepaal een gemiddelde waarde voor molaire absorptie, de standaardafwijking en de statistische fout geassocieerd met het gemiddelde.
Oplossing
Molair absorptie wordt berekend voor elk van de geteste concentraties. Bedenk dat de verlichtingsomstandigheden en optische afstand vast blijven.
De resultaten voor molaire absorptie zijn:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 in eenheden van 1/(m*cm).
Uit deze resultaten kunnen we de gemiddelde waarde nemen:
= 1998 (m*cm)^-1
Met een standaardafwijking van: 184 (m*cm)^-1
De gemiddelde fout is de standaardafwijking gedeeld door de vierkantswortel van het gegevensnummer, dat wil zeggen:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Ten slotte wordt geconcludeerd dat de gepatenteerde stof een molaire absorberende heeft bij frequentie 589 nm geproduceerd door een natriumlamp van:
= (2000 ± 60) (m*cm)^-1
Referenties
- Atkins, P. 199999. Fysische chemie. Omega -edities. 460-462.
- De gids. Transmissie en absorptie. Hersteld van: chemie.Laguia2000.com
- Milieutoxicologie. Overdracht, absorptie en wet van Lambert. Hersteld van: repository.Innovationumh.is
- Avontuurlijke natuurkunde. Absorptie en transmissie. Hersteld van: rpfisica.Blogspot.com
- Sistofotometrie. Hersteld van: chem.Librhetxts.borg
- Milieutoxicologie. Overdracht, absorptie en wet van Lambert. Hersteld van: repository.Innovationumh.is
- Wikipedia. Absorptie. Hersteld van: Wikipedia.com
- Wikipedia. Spectrofotometrie. Hersteld van: Wikipedia.com
- « Latijns -Amerikaanse avant -Garde context, kenmerken, auteurs
- Totalitarisme oorsprong, kenmerken, oorzaken en gevolgen »

