Basisoxiden

- 3761
- 835
- Dr. Rickey Hudson
We leggen uit wat de basisoxiden zijn, hoe hun eigenschappen, nomenclatuur en verschillende voorbeelden worden gevormd,
 Veel basisoxiden hebben opvallende, kenmerkend voor metalen kleuren
Veel basisoxiden hebben opvallende, kenmerkend voor metalen kleuren Wat zijn basisoxiden?
De Basisoxiden Het zijn anorganische verbindingen die worden gevormd door de unie tussen zuurstof en een metaal. Ze worden basisoxiden genoemd omdat ze alkalische of basisoplossingen produceren bij het oplossen in water. Ook omdat ze reageren met zuren om een zout en water te vormen door een zuur-base neutralisatiereactie.
Basisoxiden zijn heel gebruikelijk. In feite zijn de meeste metalen in de natuur te vinden in oxidebodems, dus werden ze land genoemd.
Basisoxiden zijn van groot belang voor de industrie. Veel gekleurde pigmenten die in de industrie worden gebruikt, zijn oxiden. Andere oxiden worden gebruikt als basis voor schilderijen, met name titanium-, lood- en zinkoxiden.
Basisoxideneigenschappen
Het zijn binaire verbindingen
Deze verbindingen worden alleen gevormd door twee elementen: zuurstof en een metaal. Daarom zijn het binaire verbindingen.
De empirische formule is m2OFX of moX/2
De valentie van zuurstof in oxiden is altijd -2, dus de empirische formules van de oxiden worden vereenvoudigd wanneer de metalen Valencia een koppelnummer is. Hetzelfde gebeurt echter niet als het vreemd is.
De empirische formule van natriumoxide is bijvoorbeeld NA2Of omdat het natrium Valencia +1 heeft (oneven). In plaats daarvan is de empirische formule van calciumoxide CAO, omdat calcium Valencia +2 heeft.
Het zijn anorganische verbindingen, bijna altijd ionisch
De meeste basische oxiden zijn kristallijne ionische verbindingen. Dit omvat de oxiden van alle alkalische metalen, van alle alkaliners (behalve Beryllium) en de eerste reeks overgangsmetalen.
Kan u van dienst zijn: chemische bindingZe hebben een zeer hoge fusie en kookpunten
De ionische binding houdt alle ionen die basisoxiden vormen die sterk verenigd zijn. Dit maakt ze moeilijk om te smelten en nog moeilijker te verdampen. Om deze reden hebben ze zeer hoge fusie en kookpunten.
Ze zijn vast bij kamertemperatuur
Vanwege hetzelfde feit dat ze hoge fusiepunten hebben, zijn alle basisoxiden vast bij kamertemperatuur.
Het zijn basisverbindingen
De reden waarom ze basisoxiden worden genoemd, is juist vanwege de eigenschappen van zuurbasis. Oxiden met groter ionisch karakter produceren basisoplossingen bij het oplossen in water en reageren ook met zuren, neutraliseren.
Er moet echter worden opgemerkt dat niet alle metaaloxiden basic zijn. Sommige zijn neutraal, andere zuren en andere amfotor.
De meeste zijn weinig oplosbaar of onoplosbaar in water
Alle basisoxiden zijn onoplosbaar in water, met uitzondering van alkalische en bariummetalen oxiden. Ze zijn echter oplosbaar in zure oplossingen.
Hoe zijn basisoxiden?
Basisoxiden kunnen spontaan worden gevormd wanneer metalen worden blootgesteld aan luchtzuurstof. In feite bestaan corrosielagen die worden gevormd op het oppervlak van metalen uit verschillende basisoxiden.
Het betrokken metaal is in het algemeen een alkalisch, alkalisch metaal of een overgangsmetaal.
U kunt drie algemene reacties schrijven voor de vorming van oxiden, afhankelijk van of de metalen Valencia gelijk of vreemd is:
Voor metalen met vreemde valenties:
Wanneer het metaal een vreemde valentie heeft, is de algemene reactie van de vorming van oxide:

Voor de vorming van natriumoxide, waarbij natrium Valencia +1 heeft, is de reactie bijvoorbeeld:
Het kan u van dienst zijn: fosfor: geschiedenis, eigenschappen, structuur, verkrijgen, gebruik
Een ander voorbeeld is de vorming van ijzeroxide, waarbij ijzer oxidatie of Valencia +3 heeft. In dit geval is de reactie:

Voor metalen met Valencia +2:
Wanneer het metaal Valencia +2 heeft, is de algemene reactie van oxidevorming:

In het geval van calciumoxide -vorming, waarbij calcium Valencia +2 heeft, is de reactie bijvoorbeeld:

Voor metalen met andere paren:
Wanneer het metaal naast +2 zelfs valenties heeft, is de algemene reactie van oxidevorming:
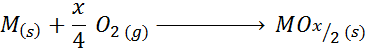
Een voorbeeld van dit geval is de vormingsreactie van titaniumoxide (IV):

Basisoxiden Nomenclatuur
Er zijn drie nomenclatuursystemen voor de basisoxiden die zijn: de traditionele nomenclatuur, de voorraad en de systematische.
Om een oxide te noemen volgens de eerste twee nomenclature -systemen is het noodzakelijk om de metaal Valencia te kennen, terwijl het voor het laatst.
Traditionele nomenclatuur
Volgens de traditionele nomenclatuur worden basisoxiden genoemd beginnen met het woord ofXido gevolgd door de kationnaam. Deze achternaam wordt gebouwd door de wortel van de metalen naam en een systeem van voorvoegsels en achtervoegsels aangegeven door de metalen Valencia te plaatsen:
Oxyde + Voorvoegsel-raí-sufijo
De regels voor het toewijzen van voorvoegsels en achtervoegsels zijn samengevat in de volgende tabel:
Aantal mogelijke valenties | Valencia | Voorvoegsel | Achtervoegsel |
1 enkele Valencia | |||
Alleen | --- | ___ico | |
2 Valencias | |||
Bejaard | --- | ___ico | |
Minderjarige | --- | ___beer | |
3 valenties | |||
Bejaard | --- | ___ico | |
Tussenliggend | --- | ___beer | |
Minderjarige | Hik___ | ___beer | |
4 valenties | |||
Bejaard | Per___ | ___ico | |
Major Intermediate | --- | ___ico | |
Minor intermediair | --- | ___ico | |
Minderjarige | Hik___ | ___ico |
Voorbeeld:
Hij Vertrouwen2OF3 Het is een ijzeroxide met Valencia +3. IJzer heeft slechts twee valenties die +2 en +3 zijn, dus in dit oxide heeft het ijzer de oudste van twee valenties. Om deze reden wordt het achtervoegsel toegevoegd ___ico aan de wortel van de naam van het ijzeren metaal dat is Reuzen-.
Het kan u van dienst zijn: geen elektrolyten: kenmerken en voorbeeldenDaarom de traditionele naam van Vertrouwen2OF3 is: IJzeroxide.
Voorraadnomenclatuur
In dit systeem is de naam gebouwd, beginnend met de woorden oxyde van, gevolgd door metalen naam. Ten slotte wordt zijn Valencia tussen haakjes in Romeinse getallen geplaatst:
Metaal + naamoxide (Valencia)
In het geval dat het metaal slechts één valentie heeft, wordt deze weggelaten.
Voorbeeld:
In Cr2OF3 Chromium heeft Valencia +3, dus de naamvoorraad is Chrome -oxide (III).
Systematische nomenclatuur
Dit is de enige van de drie nomenclatures die de metalen Valencia niet specificeert. Sitematische namen geven aan hoeveel zuurstof- en metaalatomen de verbinding bevatten met numerieke voorvoegsels.
De naam is gebouwd met het woord oxyde voorafgegaan door hem voorvoegsel dat het aantal zuurstof aangeeft, Dan het artikel van gevolgd door Metaalnaam met zijn respectieve voorvoegsel.
Voorvoegsel-oxide + van + voorvoegsel-metal
Sommige voorvoegsels zijn:
Nummer | Voorvoegsel |
1 | Knobbeltje |
2 | Gaf |
3 | Tri |
4 | Tetra |
5 | Penta .. |
Voorbeeld:
In de systematische nomenclatuur, de CR2OF3 Het wordt dichroma -trioxide genoemd, omdat het drie zuurstof en twee chromos heeft.
Voorbeelden van basisoxiden
- Natriumoxide - NA2OF
- Ferrisch oxide - geloof2OF3
- IJzermonoxide - lelijk
- Cromic -oxide - Cr2OF3
- Divanadio pentaoxide - v2OF5
- Kaliumoxide - k2OF
- Bariumoxide - Bao

