Kaliumoxide (K2O)
- 1321
- 342
- Aaron Okuneva
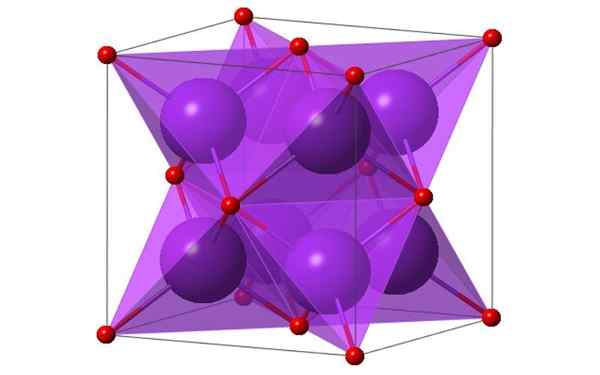
 Kubiek ontwerp van 4 moleculen kaliumoxide. Bron: Ktlabe, Wikimedia Commons
Kubiek ontwerp van 4 moleculen kaliumoxide. Bron: Ktlabe, Wikimedia Commons Wat is kaliumoxide?
Hij kaliumoxide, Ook wel dipotasiumoxide genoemd, het is een ionische zuurstof en kaliumzout, met formule k2OF. Het is het eenvoudigste kaliumoxide, zeer reactief en zelden gevonden. Sommige handelsmaterialen, zoals meststoffen en cement2OF.
Kaliumoxide wordt geproduceerd uit kaliumhydroxide (bijtende potassa) en 450 ° C metallic kalium, waardoor moleculaire waterstof wordt geproduceerd volgens de vergelijking:
2K + 2KOH ⇌ 2K2Of + h2 (450 ° C).
Het wordt ook verkregen door het verminderen van kaliumperoxide volgens de reactie:
2k2OF2 → K2Of + o2 (530 ° C).
Een andere methode voor het verkrijgen van kaliumoxide is door het verwarmen van kaliumcarbonaat bij hoge temperatuur, zoals aangegeven door de volgende reactie:
K2CO3 ⇌ K2O + co₂ (t> 1200 ° C).
De belangrijkste manier om kaliumoxide te verkrijgen is echter door het verwarmen van kaliumnitraat, het verkrijgen van moleculaire stikstof zoals aangegeven door de volgende reactie:
2KNO3 + 10K → 6K2Of + n2
Fysische en chemische eigenschappen
- Het zijn tetraëdrische kristallen, geelachtig, zonder karakteristiek aroma.
- Het heeft een molecuulgewicht van 94,2 g/mol en een dichtheid van 2,13 g/ml bij 24 ° C.
- Het heeft een smeltpunt van 740 ° C, hoewel het begint te ontleden bij 300 ° C.
- Het is bestand tegen warmte en oplosbaar in ethanol en ether. K2Of kristalliseren in de antifluorietstructuur. Om deze reden worden de posities van de anionen en kationen geïnvesteerd in relatie tot hun posities in CAF2, met gecoördineerde kaliumionen tot 4 ionen oxide en oxide -ionen gecoördineerd bij 8 kalium.
- Het is een basisoxide en reageert gewelddadig met water om bijtende kaliumhydroxide te produceren. Het is delicoscent en absorbeert water uit de atmosfeer, beginnend met deze krachtige reactie.
Het kan u van dienst zijn: calciumnitraat (Ca (NO3) 2)- Het oxideert omkeerbaar tot kaliumperoxide bij 350 ° C, reageert heftig met zuren, zoals zoutzuur, om kaliumzouten te vormen volgens de reactie:
K2O + 2HCl → 2KCL + H₂O.
- Reageert met stikstofdioxide om nitraat en kaliumnitriet te vormen bij temperaturen tussen 150 en 200 ° C:
K2O + 2no2 = Kno2 + Kno3
- Reageer bij lage temperaturen met ammoniak om amidas en kaliumhydroxide te vormen volgens de reactie:
K2O + NH3 (L) → KNH2↓ + KOH (-50 ° C).
Risico's
Kaliumoxide is een onstabiele substantie. Gemakkelijk oxideert andere kalium-, peroxide- of kaliumzuur (kho) oxiden (kho). De verbinding is geen brandstof, maar reageert krachtig en exothermisch met water om kaliumhydroxide te vormen (KOH).
Kaliumoxide -oplossing in water is een sterke basis, reageert gewelddadig met zuur en is corrosief. Reageert heftig met water dat kaliumhydroxide produceert. Valt veel metalen aan in aanwezigheid van water.
De stof is corrosief voor ogen, huid en luchtwegen, evenals door in te nemen. Aerosolinademing kan longoedeem veroorzaken, waarvan de symptomen vaak na een paar uur worden gemanifesteerd en worden verergerd door fysieke inspanningen.
In geval van oogcontact moet u controleren of contactlenzen worden gebruikt en deze onmiddellijk verwijderen. De ogen moeten minimaal 15 minuten worden gewassen met stromend water, met open oogleden. Koud water kan worden gebruikt, en geen oogzalf.
Als de chemische stof in contact komt met de kleding, behoudt deze dan zo snel mogelijk en beschermt het zijn eigen handen en lichaam. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt in de blootgestelde huid, zoals de handen, wordt de huid besmet met stromend water en niet -boordelijke zeep zacht gewassen en voorzichtig. Koud water kan worden gebruikt. Als irritatie aanhoudt, zoek dan medische aandacht. Was besmette kleding voordat u het opnieuw gebruikt.
Het kan u van dienst zijn: Rubidio: geschiedenis, eigenschappen, structuur, verkrijgen, gebruikAls het huidcontact ernstig is, moet het worden gewassen met een desinfecterende zeep en de huid bedekken met een antibacteriële crème.
In het geval van inhalatie moet het slachtoffer in een goed geventileerd gebied worden toegestaan. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilig gebied worden geëvacueerd.
Draai strakke kleding los, zoals shirthals, riemen of stropdas. Als het slachtoffer moeilijk te ademen is, moet zuurstof worden toegediend. Als het slachtoffer niet ademt, wordt een mondreanimatie van de mond gemaakt.
Altijd rekening houdend dat het gevaarlijk kan zijn voor de persoon die hulp biedt om mond aan mondreanimatie te geven wanneer het geïnhaleerde materiaal giftig, besmettelijk of corrosief is.
In het geval van inname veroorzaakt het geen braken. Draai de strakke kleding los. In alle gevallen moet onmiddellijk medische hulp worden gevraagd.
Toepassingen
- De chemische formule k2Of (of eenvoudig k) wordt gebruikt in verschillende industriële contexten: N-P-K-nummers voor meststoffen, cementformules en glasformules.
Het wordt vaak niet rechtstreeks in deze producten gebruikt, maar de hoeveelheid kalium wordt gerapporteerd in termen van k -equivalent2Of voor elk type kaliumverbindingen dat wordt gebruikt, zoals kaliumcarbonaat.
- Kaliumoxide is ongeveer 83% van kalium in gewicht, terwijl kaliumchloride slechts 52% is. Kaliumchloride biedt minder kalium dan een gelijke hoeveelheid kaliumoxide.
Daarom, als een meststof 30% kaliumchloride is door gewicht, zou de standaard kaliumindex, gebaseerd op kaliumoxide, slechts 18,8% zijn. Het wordt vervaardigd en/of tussen 10 en 100 ton per jaar van deze stof in de Europese economische ruimte.
Kan u van dienst zijn: chemie in het dagelijks leven: +30 voorbeelden- Deze stof wordt gebruikt in laboratoriumchemicaliën, meststoffen, polymeren en fytosanitaire producten. De K2O Het heeft een industrieel gebruik dat resulteert in de vervaardiging van een andere stof (gebruik van tussenproducten).
- Kaliumoxide wordt gebruikt op het gebied van mengsel en/of landbouw, bosbouw en visserijformulering. Het wordt gebruikt voor de productie van chemicaliën, plastic producten en minerale producten (bijvoorbeeld gips, cement).
- Het wordt buiten gebruikt in langetermijnmaterialen met lage snelheidafgifte, bijvoorbeeld metaal-, hout- en plastic bouwmaterialen.
- Interieur, langetermijnmaterialen worden gebruikt met lage release snelheid, zoals meubels, speelgoed, bouwmaterialen, gordijnen, schoeisel, leerproducten, papier- en kartonnen producten, elektronische apparatuur.
- Deze stof is te vinden in producten met op steen gebaseerd materiaal, gips, cement, glas of keramiek (bijvoorbeeld platen, potten / pannen, voedselopslagcontainers, constructie- en isolatiemateriaal).
- Kaliumoxide is een thermisch stabiele, zeer onoplosbare bron, geschikt voor glas-, optische en keramische toepassingen. Oxideverbindingen leiden geen elektriciteit.
- Het wordt ook gebruikt in lichte structurele componenten in ruimtevaart- en elektrochemische toepassingen zoals brandstofbatterijen waarin ionengeleidbaarheid vertoont.
Referenties
- Amerikaanse elementen (s.F.)). Kaliumoxide. Hersteld van Amerikanen.com.
- Dipassiumoxide. Hersteld van echa.Europa.EU.

