Goudoxide (iii) (au2o3) wat is, structuur, eigenschappen, gebruik
- 1888
- 327
- Ernesto McKenzie
Hij Goudoxide (III) Het is een anorganische verbinding waarvan de chemische formule au is2OF3. Theoretisch zou de aard ervan kunnen worden verwacht buiten het covalente type. De aanwezigheid van een bepaald ionisch karakter in zijn vaste stof kan echter niet volledig worden uitgesloten; of wat hetzelfde is, neem de afwezigheid van het AU -kation aan3+ naast anion of2-.
Het lijkt misschien tegenstrijdig dat goud, een edelmetaal zijn, kan oxideren. Onder normale omstandigheden kunnen gouden stukken niet oxideren door contact met de zuurstof van de atmosfeer; Wanneer ze echter worden bestraald met ultraviolette straling in aanwezigheid van ozon, of3, Het panorama is een andere.
Als de gouden sterren deze omstandigheden ondergaan, zouden ze een roodachtige bruine kleur worden, kenmerkend voor de au2OF3.
Andere methoden om dit oxide te verkrijgen, zouden de chemische behandeling van deze sterren impliceren; Bijvoorbeeld, het deeg van goud in zijn respectieve chloride, AUCL om te zetten3.
Dan naar de AUCL3, En de rest van de mogelijke gevormde goudzouten, wordt een sterk basismedium toegevoegd; En hiermee wordt gehydrateerd of hydroxide -oxide verkregen, AU (OH)3. Ten slotte is de laatste verbinding thermisch uitgedroogd om de au te verkrijgen2OF3.
Goudoxidestructuur (III)
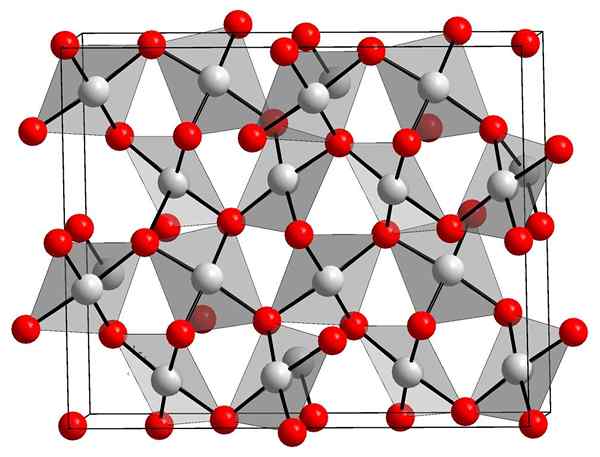
 Goudoxide kristallijne structuur. Orci, Wikimedia Commons.
Goudoxide kristallijne structuur. Orci, Wikimedia Commons. Het bovenste beeld toont de kristallijne structuur van goudoxide (iii). De opstelling van goud- en zuurstofatomen in de vaste stof wordt getoond, hetzij rekening houdend met neutrale atomen (covalente vaste stof), of ionen (ionische vaste stof). Uitwisselbaar, elimineer of plaats de AU-O-links in elk geval.
Volgens het beeld wordt aangenomen dat het covalente karakter overheerst (wat logisch zou zijn). Om die reden worden de atomen en links die worden weergegeven met bollen en staven getoond, respectievelijk getoond. Witte bollen komen overeen met gouden atomen (auIII-O), en de roodachtige naar zuurstofatomen.
Kan u van dienst zijn: hydroxyapatietAls het zorgvuldig wordt waargenomen, is het te zien dat er auo -eenheden zijn4, die binden door zuurstofatomen. Een andere manier om te visualiseren zou zijn om te overwegen dat elke au3+ is omgeven door vier of2-; Natuurlijk, vanuit een ionisch perspectief.
Deze structuur is kristallijn omdat atomen worden geordend door hetzelfde lang -range patroon te gehoorzamen. De unitaire cel komt dus overeen met het rhombohedrale kristallijne systeem (hetzelfde als het bovenste beeld). Daarom alle au2OF3 Het zou kunnen worden gebouwd als al die bollen van de eenheidscel in de ruimte zouden worden verdeeld.
Elektronische aspecten
Goud is een overgangsmetaal en er wordt verwacht dat de 5D -orbitalen rechtstreeks interageren met de 2P -orbitalen van het zuurstofatoom. Deze overlapping van zijn orbitalen moet theoretisch rijbanden genereren, wat de au zou maken2OF3 In een halfgeleider solide.
Daarom is de ware structuur van de au2OF3 is nog complexer om dit in gedachten te hebben.
Hydrateren
Gouden oxide kan watermoleculen behouden in zijn rhomboédicanische kristallen, die aanleiding geeft tot hydrates. Wanneer dergelijke hydraten worden gevormd, wordt de structuur amorf.
De chemische formule voor dergelijke hydraten kan een van de volgende zijn, die in feite niet diep worden opgehelderd: au2OF3∙ ZH2O (Z = 1, 2, 3, enz.), Au (oh)3, of auXOFEn(OH)Z.
De AU (OH) formule3 vertegenwoordigt een vereenvoudiging van de ware samenstelling van deze hydraten. Dit komt omdat binnen goudhydroxide (III) onderzoekers ook de aanwezigheid van AU hebben gevonden2OF3; En daarom verliest het de betekenis om het op zichzelf te behandelen als een "eenvoudige" overgangsmetaalhydroxide.
Kan u van dienst zijn: evenwicht tussen vloeistof en dampAan de andere kant, van een solide met AU -formuleXOFEn(OH)Z Een amorfe structuur kan worden verwacht; Omdat dit afhangt van de coëfficiënten X, En En Z, waarvan de variaties zouden resulteren in alle soorten structuur die nauwelijks een kristallijn patroon kunnen vertonen.
Eigenschappen
Fysiek uiterlijk
Het is een roodbruine vaste stof.
Moleculaire massa
441,93 g/mol.
Dikte
11.34 g/ml.
Smeltpunt
Het smelt en ontleedt bij 160 ° C. Het mist een kookpunt, dus dit oxide kookt nooit.
Stabiliteit
Au2OF3 Het is thermodynamisch onstabiel omdat, zoals in het begin vermeld, goud niet de neiging heeft om te oxideren in normale temperatuuromstandigheden. Zodat het gemakkelijk wordt gereduceerd om het nobele goud te worden.
Hoe hoger de temperatuur, hoe sneller deze reactie zal zijn, wat bekend staat als thermische ontleding. Dus de au2OF3 Bij 160 ° C breekt het af om metaalgoud te produceren en moleculaire zuurstof af te geven:
2 au2OF3 => 4 au + 3 o2
Een zeer vergelijkbare reactie kan optreden met andere verbindingen die voorstander zijn van deze reductie. Waarom reductie? Omdat goud de elektronen wint die zuurstof verwijdert; Wat is hetzelfde als om links naar zuurstof te verliezen.
Oplosbaarheid
Het is een onoplosbare vaste stof in water. Het is echter oplosbaar in zoutzuur en salpeterzuur, vanwege de vorming van goudchloriden en nitraten.
Nomenclatuur
Het goudoxide (III) is de naam die wordt beheerst door de voorraadnomenclatuur. Andere manieren om het te vermelden zijn:
-Traditionele nomenclatuur: auricoxide, omdat Valencia 3+ de grootste is voor goud.
-Systematische nomenclatuur: Dioro -trioxide.
Toepassingen
Glazen kleuring
Een van de meest vooraanstaande toepassingen is om een roodachtige kleur te bieden aan bepaalde materialen, zoals een bril, naast het verlenen van bepaalde eigenschappen die inherent zijn aan gouden atomen.
Kan u van dienst zijn: waterstofbromide (HBR)Synthese van auraten en fulminant goud
Als de AU wordt toegevoegd2OF3 Aan een medium waar het oplosbaar is, en in aanwezigheid van metalen kan het neerslaan na de toevoeging van een sterke basis de auraten; die worden gevormd door auo anions4- In het gezelschap van metalen kationen.
Ook de au2OF3 reageert met ammoniak om de fulminante gouden verbinding te vormen, au2OF3(NH3))4. Zijn naam komt voort uit het feit dat het zeer explosief is.
Zelf geassembleerde monocapas manipulatie
Op goud en zijn oxide worden bepaalde verbindingen niet op dezelfde manier geadsorbeerd, zoals Disulfur Dialil, RSSR. Wanneer deze adsorptie optreedt, wordt een Au-S-binding spontaan gevormd, waarbij het zwavelatoom de chemische kenmerken van dit oppervlak vertoont en definieert, afhankelijk van de functionele groep waaraan deze is gekoppeld.
RSSR kan niet worden geadsorbeerd via au2OF3, Maar over metalen goud. Daarom, als het oppervlak van goud en de mate van oxidatie ervan wordt gemodificeerd, evenals de grootte van de deeltjes of lagen van AU2OF3, Een meer heterogeen oppervlak kan worden ontworpen.
Dit oppervlak au2OF3-AUSR interageert met metaaloxiden van bepaalde elektronische apparaten, waardoor toekomstige slimmere oppervlakken worden ontwikkeld.
Referenties
- Goudoxiden. Hersteld van: 911Metallurgist.com
- Shi, r. Asahi en C. Stampfl. (2007). Eigenschappen van de gouden oxiden au2OF3 en au2O: First-Principles Research. De American Physical Society.
- « ChigualCan wat is, kenmerken, habitat, gebruik, eigenschappen
- Hemidemosomen wat is, beschrijving, structuur, functies »

