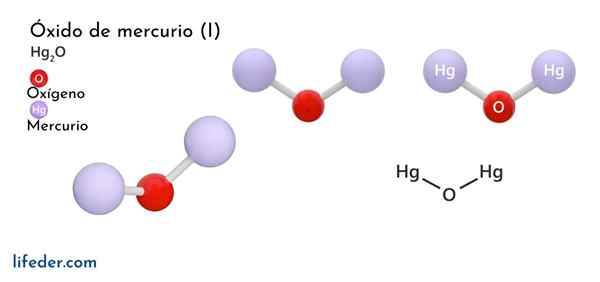
Kwikoxide (hg2o)
- 2516
- 307
- Irving McClure I
Wat is kwikoxide?
Hij Kwikoxide (I) u ferrisch oxide, wiens chemische formule wordt weergegeven als Hg2Of het is een vaste faseverbinding, beschouwd als giftig en onstabiel vanuit chemisch oogpunt, die transformeert in kwik in zijn elementaire vorm en kwikoxide (ii).
Er zijn slechts twee chemische soorten die kwik kunnen vormen in combinatie met zuurstof, omdat dit metaal twee alleen oxidatietoestanden heeft (Hg+ en HG2+): Kwikoxide (i) en kwikoxide (ii). Kwikoxide (II) bevindt zich in een toestand van vaste aggregatie en verkrijgt in twee relatief stabiele kristallijne vormen.
Deze verbinding staat ook gewoon bekend als kwikoxide, dus alleen deze soort zal hier worden behandeld. Een veel voorkomende reactie die optreedt bij deze stof is dat, wanneer het onderworpen is aan opwarming, de ontleding ervan optreedt, waardoor kwik en gasvormige zuurstof in een endothermisch proces wordt geproduceerd.
Chemische structuur
Onder atmosferische drukomstandigheden wordt deze soort gepresenteerd in twee kristallijn. Beide vormen worden omgezet in tetragonaal boven 10 GPa druk.
De structuur van de cinnabrio is gebaseerd op primitieve zeshoekige cellen (HP6) met trigonale symmetrie, waarvan de spiraalvormige as aan de linkerkant is georiënteerd (P32eenentwintig); Aan de andere kant is de structuur van het montrodiet ortorrombisch, gebaseerd op een primitief rooster dat vlakken vormt van glijdende loodrecht op de drie assen (PNMA).
Twee vormen van kwikoxide kunnen daarentegen visueel worden onderscheiden, omdat de ene rood is en de andere geel. Dit onderscheid in kleur vindt plaats dankzij de afmetingen van het deeltje, omdat de twee vormen dezelfde structuur hebben.
Het kan u van dienst zijn: Circonium: geschiedenis, eigenschappen, structuur, risico's, gebruikOm de rode vorm van kwikoxide te produceren, metalen kwikverwarming in zuurstof bij een temperatuur rond 350 ° C, of van het kwiknitraatpyrolyseproces (II) (Hg (nee (nee3))2)).
Op dezelfde manier, om de gele vorm van dit oxide te produceren2+ in waterige vorm met een basis.
Kwikoxide -eigenschappen
- Het heeft een smeltpunt van ongeveer 500 ° C (gelijkwaardig aan 773 K), waarboven het lijdt aan ontleding, en een molaire massa of molecuulgewicht van 216,59 g/mol.
- Het is in een toestand van vaste aggregatie in verschillende kleuren: oranje, rood of geel, volgens de mate van dispersie.
- Het is een oxide van anorganische aard, wiens aandeel met zuurstof 1: 1 is, waardoor het een binaire soort is.
- Het wordt als onoplosbaar beschouwd in ammoniak, aceton, ether en alcohol, evenals in andere biologische aard.
- De oplosbaarheid in water is zeer laag, is ongeveer 0,0053 g/100 ml bij standaardtemperatuur (25 ° C) en neemt toe met de temperatuurstijging.
- Het wordt in de meeste zuren als oplosbaar beschouwd; De gele vorm vertoont echter een grotere reactiviteit en een groter vermogen voor oplossing.
- Wanneer het kwikoxide wordt blootgesteld aan de ontleding, terwijl de rode vorm het doet wanneer het wordt blootgesteld aan lichtbronnen.
- Door te worden onderworpen aan het opwarmen van de temperatuur waarin hij afbreekt, brengt hij kwikgassen met hoge toxiciteit vrij.
- Alleen wanneer het wordt verwarmd tot 300-350 ° C kan kwik worden gecombineerd met zuurstof met een winstgevende snelheid.
Kan u van dienst zijn: chemische suspensiesGebruik/toepassingen
Het wordt gebruikt als een voorloper bij het verkrijgen van elementair kwik, omdat het op een vrij eenvoudig ontledingsprocessen lijdt; Op zijn beurt, wanneer het ontbindt, produceert het zuurstof in zijn frisdrankvorm.
Evenzo wordt dit anorganische natuuroxide gebruikt als een waarde -opdrachtmiddel van het standaardtype voor anionische soorten, omdat een verbinding wordt gegenereerd die een grotere stabiliteit heeft dan de initiële vorm.
In deze zin ervaart kwikoxide oplossing wanneer het wordt gevonden in geconcentreerde oplossingen van basissoorten, waardoor verbindingen worden geproduceerd genaamd Hydroxocomplexes.
Deze verbindingen zijn complex met M -structuurX(OH)En, waarbij M een metalen atoom vertegenwoordigt en subscripten x y y vertegenwoordigen het aantal keren dat soorten in de molecuul worden gevonden. Ze zijn van enorm nut in chemisch onderzoek.
Bovendien kan kwikoxide (II) worden gebruikt in laboratoria voor de productie van verschillende metaalzouten; Bijvoorbeeld, kwikacetaat (II), dat wordt gebruikt in organische syntheseprocessen.
Deze verbinding wordt ook gebruikt, wanneer gemengd met grafiet, als een materiaal voor de kathodische elektrode bij de productie van kwikbatterijen en elektriciteits- en zinkoxide -type cellen.
Risico's
- Deze stof, die basiskenmerken op een zeer zwakke manier manifesteert, is een zeer nuttig reagens voor verschillende toepassingen zoals die hierboven vermeld, maar vormt op hun beurt belangrijke risico's voor de mens wanneer deze hieraan wordt blootgesteld.
- Kwikoxide heeft een hoge toxiciteit, kunnen worden geabsorbeerd door de luchtwegen, omdat het irritante gassen afgeeft wanneer het in de vorm van aerosol is, naast extreem gift het komt hiermee rechtstreeks in contact.
Kan u van dienst zijn: chiraliteit- Deze verbinding veroorzaakt oogirritatie en kan schade aan de nieren veroorzaken die vervolgens worden ontleend aan problemen met nierfalen.
- Wanneer ze op de een of andere manier worden geconsumeerd door aquatische soorten, is deze chemische stof hierin bioacumula en beïnvloedt het organisme van mensen die ze regelmatig consumeren.
- De verwarming van kwikoxide is kwikdampen afkomstig van kwikdampen die een hoge toxiciteit hebben naast gaszuurstof, waardoor het risico op ontvlambaarheid wordt verhoogd; dat wil zeggen, om branden te produceren en de verbranding hierbij te verbeteren.
- Dit anorganische oxide heeft een krachtig oxidatiegedrag, dus het produceert gewelddadige reacties wanneer het in contact komt met reductiemiddelen en bepaalde chemische stoffen zoals zwavelchloride (CL2S2), waterstofperoxide (h2OF2), chloor en magnesium (alleen wanneer hij wordt verwarmd).