Booroxide (B2O3) wat is, structuur, eigenschappen, gebruik
- 2671
- 829
- Hugo Crooks
Hij booroxide o Borisch anhydride is een anorganische verbinding waarvan de chemische formule B is2OF3. Omdat het boor- en zuurstofelementen van blok P van de periodieke tabel zijn, en nog meer hoofden van hun respectieve groepen, is het verschil in elektronegativiteit tussen hen niet erg hoog; Daarom wordt verwacht dat de B2OF3 van covalente aard zijn.
De B2OF3 Het wordt bereid door borax op te lossen in geconcentreerd zwavelzuur in een fusieoven en bij een temperatuur van 750 ° C; Thermisch uitdrogen boorzuur, B (OH)3, bij een temperatuur van ongeveer 300 ° C; of het kan ook worden gevormd als een product van de Diborano -reactie (B2H6) Met zuurstof.
Boro -oxide kan een semi -transparant of kristallijn glazen uiterlijk hebben; De laatste door slijpen kan worden verkregen in stofvorm.
Hoewel het niet op het eerste moment lijkt te zien, wordt de B overwogen2OF3 als een van de meest complexe anorganische oxiden; Niet alleen vanuit structureel oogpunt, maar ook vanwege de variabele eigenschappen die het glas en de keramiek verwerven waaraan ze aan hun matrix worden toegevoegd.
Boro -oxidestructuur
Unity Bo3
De B2OF3 Het is een covalente vaste stof, dus in theorie bestaan ze niet in zijn ion B -structuur3+ noch2-, Maar B-O Links. Boron kan volgens Valencia's Link Theory (TEV) slechts drie covalente links vormen; In dit geval drie B-O-links. Als gevolg hiervan moet de verwachte geometrie trigonaal zijn, bo3.
Het BO -molecuul3 Het zijn slechte elektronen, vooral zuurstofatomen; Verschillende van hen kunnen echter met elkaar communiceren om deze tekort te leveren. Dus de driehoeken bo3 Ze worden vergezeld door een zuurstofbrug te delen en worden in de ruimte gedistribueerd als driehoekige rijen netwerken met hun vliegtuigen op verschillende manieren georiënteerd.
Kan u van dienst zijn: onverzadigde oplossingKristallijne structuur
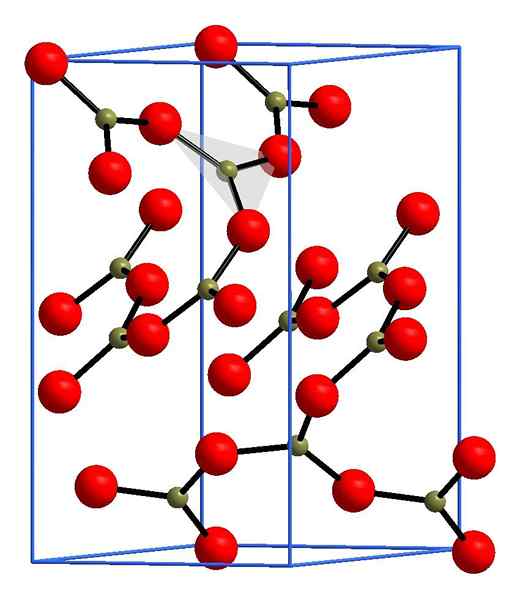
 Boro -oxidestructuur. Andif1, Wikimedia Commons.
Boro -oxidestructuur. Andif1, Wikimedia Commons. In de bovenste afbeelding een voorbeeld van deze rijen met driehoekige eenheden BO3. Als het zorgvuldig wordt waargenomen, wijzen niet alle gezichten van de plannen naar de lezer, maar op de andere kant. De oriëntaties van deze gezichten kunnen verantwoordelijk zijn voor hoe B wordt gedefinieerd2OF3 Bij een bepaalde temperatuur en druk.
Wanneer deze netwerken een structureel patroon met een lange reeks hebben, is het een kristallijne vaste stof, die kan worden gebouwd uit de eenheidscel. Hier wordt gezegd dat de B2OF3 Het heeft twee kristallijne polymorfen: α en β.
De α-B2OF3 Het wordt geproduceerd in omgevingsdruk (1 atm), en er wordt gezegd dat het kinetisch onstabiel is; In feite is dit een van de redenen waarom booroxide waarschijnlijk een moeilijke kristallisatieverbinding is.
De andere polymorf, β-B2OF3, Hoge druk wordt verkregen in het GPA -bereik; Daarom moet de dichtheid groter zijn dan die van α-B2OF3.
Glasachtige structuur
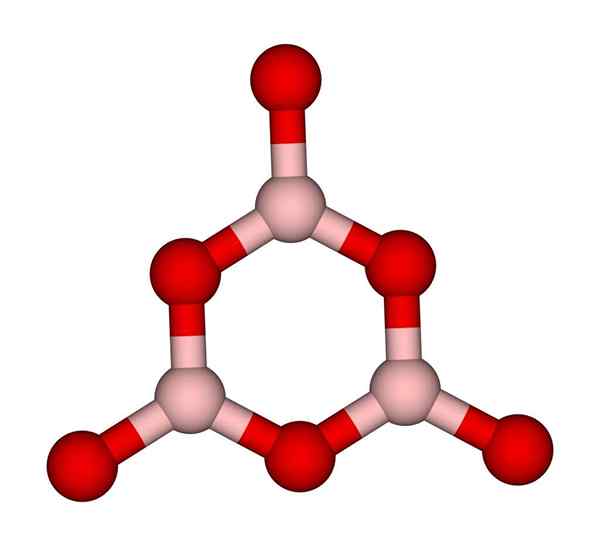 Boroxolring. CCOIL (Talk). Wikimedia Commons.
Boroxolring. CCOIL (Talk). Wikimedia Commons. BO -netwerken3 Natuurlijk hebben de neiging amorfe structuren aan te nemen; Dit zijn, die een patroon missen dat de moleculen of ionen in de vaste stof beschrijft. Door de B te synthetiseren2OF3 De overheersende vorm is amorf en niet de kristallijn; In de juiste woorden: het is een vaste stof meer glasachtig dan kristallijn.
Er wordt dan gezegd dat de B2OF3 Het is glasachtig of amorf als je jongens van Bo3 Ze zijn rommelig. Niet alleen dit, maar verander ook de manier waarop ze zich aansluiten. In plaats van te bestellen in een trigonale geometrie, eindigt een boroxolring (superieure afbeelding) om de onderzoekers te creëren (Superior Image).
Kan u van dienst zijn: 20 voorbeelden van chemische energieLet op het voor de hand liggende verschil tussen driehoekige en zeshoekige eenheden. Driehoekig karakteriseren B2OF3 kristallijn en zeshoekig tot B2OF3 glasachtig. Een andere manier om naar deze amorfe fase te verwijzen is boorglas, of door middel van een formule: G-B2OF3 (De 'G' komt uit het woord Glassy, in het Engels).
Dus G-B-netwerken2OF3 Ze zijn samengesteld uit boroxolringen en geen BO -eenheden3. De G-B2OF3 kan kristalliseren naar α-b2OF3, wat een interconversie van ringen naar driehoeken zou impliceren, en ook de mate van kristallisatie definiëren.
Eigenschappen
Fysiek uiterlijk
Het is een kleurloze en glazige vaste stof. In zijn kristallijne vorm is het wit.
Moleculaire massa
69,6182 g/mol.
Smaak
Enigszins bitter
Dikte
-Kristallijn: 2,46 g/ml.
-Glasachtig: 1,80 g/ml.
Smeltpunt
Het heeft geen volledig gedefinieerd fusiepunt, omdat het afhangt van hoe kristallijn of glasachtig het is. De puur kristallijne vorm smelt tot 450ºC; De glasachtige vorm smelt echter in een temperatuurbereik dat bedekt van 300 tot 700 ° C.
Kookpunt
Nogmaals, de gerapporteerde waarden komen niet overeen met deze waarde. Blijkbaar kookt vloeibaar booroxide (gesmolten uit zijn kristallen of zijn glas) op 1860 ° C.
Stabiliteit
Het moet droog worden gehouden, omdat het vocht absorbeert om te transformeren in boorzuur, B (OH)3.
Nomenclatuur
Boro -oxide kan op andere manieren worden genoemd, zoals:
-Diboro -trioxide (systematische nomenclatuur).
-BORON OXIDE (III) (voorraadnomenclatuur).
-Borisch oxide (traditionele nomenclatuur).
Toepassingen
Sommige toepassingen van booroxide zijn:
Boro Trihalogenuros -synthese
Van B2OF3 kan worden gesynthetiseerd door Trihalogenuros de Boro, BX3 (X = f, cl y br). Deze verbindingen zijn Lewis -zuren, en daarmee is het mogelijk om booratomen te introduceren in bepaalde moleculen om andere derivaten met nieuwe eigenschappen te verkrijgen.
Het kan u van dienst zijn: Polyiatomic ionen: lijst en oefeningenInsecticide
Een vast mengsel met boorzuur, b2OF3-B (oh)3, vertegenwoordigt een formule die wordt gebruikt als een binnenlands insecticide.
Oplosmiddel van metaaloxiden: glasvorming, keramiek en boorlegeringen
Vloeistofbooroxide kan metaaloxiden oplossen. Van dit resulterende mengsel, eenmaal gekoeld, worden vaste stoffen samengesteld uit boor en metalen verkregen.
Afhankelijk van het bedrag van B2OF3 Gebruikt, evenals de techniek, en het type metaaloxide, een rijke variëteit aan glas (borosilicaten), keramiek (nitriden en boorcarbiden) en legeringen kunnen worden verkregen (als slechts metalen worden gebruikt).
Over het algemeen verwerven glas of keramiek een grotere weerstand en sterkte, en ook een grotere duurzaamheid. In het geval van glas worden ze gebruikt voor optische en telescooplenzen, en voor elektronische apparaten.
Binder
Bij de constructie van stalen gieterijovens worden vuurvaste stenen met magnesium gebruikt. In hen wordt booroxide gebruikt als bindmiddel en helpt ze hen sterk verenigd te houden.
Referenties
- Borisch oxide. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Borix -oxide. 20 Mule Team Borax. Hersteld van: Borax.com

