Wolfraamgeschiedenis, eigenschappen, structuur, gebruik

- 4452
- 724
- James Dach
Hij wolfraam, Wolframio of Volframium is een zwaar overgangsmetaal waarvan het chemische symbool W is. Het bevindt zich in periode 6 met groep 6 van het periodiek systeem en het atoomnummer is 74. Zijn naam heeft twee etymologische betekenissen: harde stenen en wolvenschuim; De tweede is omdat dit metaal ook bekend staat als Wolframio.
Het is een zilvergrijs metaal en, zelfs als het kwetsbaar is, heeft grote hardheid, dichtheid en hoge fusie en kookpunten. Daarom is het gebruikt in al die toepassingen die hoge temperaturen, druk of mechanische krachten omvatten, zoals oefeningen, projectielen of stralingsfilamenten.
 Wolfraamstang met zijn gedeeltelijk geoxideerde oppervlak. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Wolfraamstang met zijn gedeeltelijk geoxideerde oppervlak. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Het bekendste gebruik voor dit metaal, op een cultuur en populair niveau, bevindt zich in de filamenten van de elektrische bollen. Wie ze heeft gemanipuleerd, zal zich realiseren hoe kwetsbaar ze zijn; Ze zijn echter niet gemaakt van puur wolfraam, dat kneedbaar en ductiel is. Bovendien biedt het in metalen matrices zoals legeringen uitstekende weerstand en hardheid.
Het wordt gekenmerkt en onderscheiden door het metaal te zijn met het hoogste fusiepunt, en omdat het ook dichter is dan dezelfde lead, alleen overtroffen door andere metalen zoals Osmium en Iridium. Het is ook het zwaarste metaal waarvan bekend is dat het een biologische rol in het lichaam ontmoet.
In de meeste van zijn ionische verbindingen neemt het wolfraam -anion mee, wo42-, die kunnen polymeriseren om clusters in een zuur medium te veroorzaken. Aan de andere kant kan de wolfraam intermetallische verbindingen vormen, of steriëren met metalen of anorganische zouten zodat hun vaste stoffen verschillende vormen of consistenties verwerven.
Het is niet erg overvloedig in de cortex van de aarde, met een ton ervan slechts 1,5 gram van dit metaal. Omdat het een zwaar element is, is de oorsprong ervan intergalactisch; Specifiek van de explosies van de supernova's, die tijdens hun formatie "stralen" van wolfraamatomen naar onze planeet moesten gooien.
[TOC]
Geschiedenis
Etymologie
De geschiedenis van de wolfraam of Wolframio heeft twee gezichten en hun namen: de ene Zwitsers en de andere Duits. In de jaren 1600, in regio's die momenteel worden bezet door Duitsland en Oostenrijk, werkten de mijnwerkers aan koper- en tin -extracties om bronzen te produceren.
Tegen die tijd ontmoetten de mijnwerkers een doorn in het proces: er was een extreem moeilijk mineraal; Mineraal bestond uit wolframiet, (geloof, mn, mg) wo4, die behouden of "verslonden" tin alsof het een wolf was.
Vandaar de etymologie voor dit element, 'Wolf' van Wolf in het Spaans, een wolf die aten tin; en 'ram' van schuim of room, waarvan de kristallen op een lange zwarte vacht leken. Het was zo dat de naam 'Wolfram' of 'Wolframio' naar voren kwam ter ere van deze eerste observaties.
In 1758, aan de Zwitserse kant aan een soortgelijk mineraal, de Scheelita, Cawo4, Hij heette 'Tung Sten', wat 'harde steen' betekent.
Beide namen, wolframio en wolfraam, worden op grote schaal door elkaar gebruikt, alleen afhankelijk van de cultuur. In Spanje bijvoorbeeld, en in het Europese Westen, is dit metaal meer bekend bij Wolframio; Terwijl op het Amerikaanse continent de naam van Tungsten overheerst.
Erkenning en ontdekking
Het was toen bekend dat er tussen de zeventiende en achttiende eeuw twee mineralen waren: de Wolframite en de Scheelita. Maar die een glimp van een glimp maakte dat er een ander metaal was dan de anderen? Ze konden alleen worden gekenmerkt als mineralen, en het was in 1779 dat de Ierse chemicus Peter Woulfe de wolframiet zorgvuldig analyseerde en het bestaan van wolframium had afgeleid.
Het kan u van dienst zijn: perbrominezuur (hbro4): eigenschappen, risico's en gebruikAan de Zwitserse kant was Carl Wilhelm Scheele opnieuw in 1781 in staat om de wolfraam te isoleren als wo3; En nog meer, hij verkreeg tumatisch (of wolphramisch) zuur, h2Wo4 en andere verbindingen.
Dit was echter niet voldoende om puur metaal te bereiken, omdat het nodig was om dit zuur te verminderen; dat wil zeggen, het onderwerpen aan een dergelijk proces dat niet in staat zal zijn zuurstof en kristalliseren als metaal. Carl Wilhelm Scheele had niet de juiste methode voor deze chemische reductiereactie.
Dit is waar de Spaanse broers d'Aluyar, Fausto en Juan José, die beide mineralen (Wolframite en Scheelita) met kolen hebben verminderd, in de stad Bergara, in de stad Bergara. Twee krijgen de verdienste en de eer om de ontdekkers te zijn van het Wolframium of metalen wolfraam (W).
Staal en bollen
 Elke lamp met wolfraamfilament. Bron: Pxhere.
Elke lamp met wolfraamfilament. Bron: Pxhere. Net als andere metalen definiëren het gebruik ervan zijn geschiedenis. Een van de meest prominente tegen het einde van de 19e eeuw waren de stalen-tungstenlegeringen en wolfraamfilamenten om koolstof in de elektrische bollen te vervangen. Men kan zeggen dat de eerste bollen, zoals we die kennen, in 1903-1904 werden verkocht.
Eigenschappen
Fysiek uiterlijk
Het is een zilveren en glanzend grijs metaal. Breekbaar maar van grote hardheid (niet verwarrend met vasthoudendheid). Als het stuk van hoge zuiverheid is, wordt het vervormbaar en hard, zowel of meer als meerdere staals.
Atoomnummer
74.
Molaire massa
183,85 g/mol.
Smeltpunt
3422ºC.
Kookpunt
5930ºC.
Dikte
19.3 g/ml.
Fusiewarmte
52.31 kJ/mol.
Verdampingswarmte
774 kJ/mol.
Molaire warmtecapaciteit
24.27 kJ/mol.
Moh -hardheid
7.5.
Elektronegativiteit
2,36 op de Pauling -schaal.
Atomaire radio
139 uur
Elektrische weerstand
52.8 nω · m bij 20 ° C.
Isotopen
Het presenteert voornamelijk van aard als vijf isotopen: 182W, 183W, 184W, 186W en 180W. Volgens de molaire massa van 183 g/mol, die gemiddeld de atomaire massa's van deze isotopen (en de andere dertig radio -isotopen) gemiddeld, heeft elk atoom van wolfraam of wolframium ongeveer honderd tien neutronen (74 + 110 = 184).
Scheikunde
Het is zeer bestand tegen corrosiemetaal, als zijn dunne laag wo3 Beschermt het tegen de aanval van zuurstof, zuur en alkalis. Eenmaal opgelost en neergelopen met andere reagentia, worden hun zouten verkregen, die wolframaten of wolfraam worden genoemd; In hen heeft de wolfraam een oxidatietoestand van +6 (ervan uitgaande dat er kationen zijn w6+)).
Zure clustering
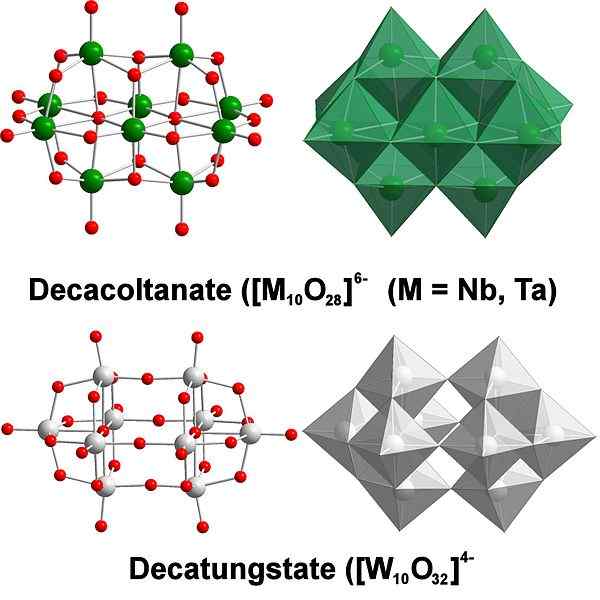 Decatungstate, een voorbeeld van wolfraam polyaxomethalaten. Bron: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Decatungstate, een voorbeeld van wolfraam polyaxomethalaten. Bron: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Chemisch gezien is de wolfraam heel bijzonder omdat zijn ionen de neiging hebben om te worden gegroepeerd (clustering in het Engels) om heteropolyciden of polyaxomethalaat te vormen. Wat zijn ze? Het zijn groepen of clusters van atomen die binden om een drie -dimensionaal lichaam te definiëren; voornamelijk, één met bolvormige kooisructuur, waarin ze een ander atoom "omsluiten".
Het begint allemaal bij het wolfraamanion, wo42-, Die in zuur medium wordt geprotoneerd (hwo4-) en gekoppeld aan een aangrenzend anion om te vormen [w2OF7(OH)2]2-; En dit sluit op zijn beurt aan een andere [w2OF7(OH)2]2- Om de [w te ontstaan4OF12(OH)4]4-. Dus tot in oplossing zijn er verschillende polytungstaten.
Kan u van dienst zijn: lithiumchloride (licl): eigenschappen, risico's en gebruikParathungstate A en B, [W7OF24]6- en h2W12OF4210-, Ze zijn respectievelijk een van de meest opvallende van deze polyades.
Het kan een uitdaging worden om zijn schets- en Lewis -structuren te overwegen; Maar het is in principe voldoende om ze te visualiseren als wo octaëder6 (bovenste afbeelding).
Merk op dat deze grijsachtige octaëder de Decatungstate definieert, een politungstate; Als een heteroátomo van binnen vergrendelt (bijvoorbeeld fosfor), zou het dan een polyaxomethalaat zijn.
Elektronische structuur en configuratie
Kristallijne fasen
Wolfraamatomen definiëren een kubieke structuur gecentreerd met het lichaam (bcc, door Lichaamsgerichte kubiek)). Deze kristallijne vorm staat bekend als de α -fase; Terwijl de β -fase ook kubiek is, maar een beetje dicht. Zowel fasen als kristallijne vormen, α en β, kunnen naast normale omstandigheden naast elkaar bestaan.
De kristallijne korrels van de a -fase zijn isometrisch, terwijl die van de β -fase lijken op kolommen. Ongeacht hoe het glas is, in deze regering. Anders konden de hoge smelt- en kookpunten niet worden verklaard, of de hoge hardheid en dichtheid van de wolfraam.
Metalen link
Tungsten -atomen moeten op de een of andere manier erg verenigd zijn. Om een vermoedens te verhogen, moet de elektronische configuratie van dit metaal eerder worden waargenomen:
[XE] 4F145 D46s2
5D -orbitalen zijn erg groot en wazig, wat zou impliceren dat tussen twee nauwe atomen W er effectieve orbitale overlappingen zijn. Ook orbitalen 6s dragen bij aan de resulterende banden, maar in mindere mate. Terwijl de 4F -orbitalen "heel diep van binnen hebben" en hun bijdrage daarom aan de metalen link lager is.
Dit, de grootte van de atomen en de kristallijne korrels, zijn de variabelen die de hardheid van de wolfraam en de dichtheid bepalen.
Oxidatietoestanden
In het wolfraam- of metaalwolframium hebben de atomen no oxidatietoestand (w0)). Terugkerend naar elektronische configuratie, kunnen 5D- en 6s -orbitalen elektronen "legen", afhankelijk van of W in het gezelschap van zeer elektronegatieve atomen, zoals zuurstof of fluor is.
Wanneer de twee 6s -elektronen verloren gaan, heeft de wolfraam oxidatietoestand +2 (w2+), Wat dat is dat het atoomcontract.
Als u ook alle elektronen van uw 5D -orbitalen verliest, wordt uw oxidatiestatus +6 (w6+); Vanaf hier kan het niet positiever worden (in theorie), omdat de 4F -orbitalen om intern te zijn grote energieën vereisen om hun elektronen te verwijderen. Dat wil zeggen dat de meest positieve oxidatietoestand +6 is, waarbij de wolfraam nog klein is.
Deze wolfraam (VI) is zeer stabiel in zure omstandigheden of in veel geoxygeneerde of gehalogeneerde verbindingen. Andere positieve en mogelijke oxidatietoestanden zijn: +1, +2, +3, +4, +5 en +6.
Wolfraam kan ook elektronen krijgen als ze worden gecombineerd met minder elektronegatieve atomen dan hij. In dit geval worden hun atomen groter. Het kan maximaal vier elektronen krijgen; dat wil zeggen, een oxidatietoestand van -4 hebben (w4-)).
Het verkrijgen van
Eerder werd vermeld dat de wolfraam wordt gevonden in Wolframite en Scheelita Minerals. Afhankelijk van het proces worden er twee verbindingen van verkregen: wolfraamoxide, wo3, of ammonium paratungstate, (NH4))10(H2W12OF42) · 4h2O (of ATP). Elk van hen kan twee worden gereduceerd tot metalen W met steenkool boven 1050 ° C.
Het kan u van dienst zijn: RAAUM Law: Principle and Formula, Voorbeelden, oefeningenHet is niet economisch winstgevend. Daarom heeft het de voorkeur om het te produceren in de vorm van stof om ooit met andere metalen om te gaan om legeringen te verkrijgen.
Het is vermeldenswaard dat de wereld van China het land is met de grootste productie van Tungsten. En op het Amerikaanse continent, Canada, Bolivia en Brazilië, bezetten ze ook de lijst van de grootste producenten van dit metaal.
Toepassingen
 Een wolfraamcarbide -verbinding: een voorbeeld van hoe de hardheid van dit metaal kan worden gebruikt om materialen onsterfelijk te maken en te verharden. Bron: SolitaryAnel (solitaritairangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Een wolfraamcarbide -verbinding: een voorbeeld van hoe de hardheid van dit metaal kan worden gebruikt om materialen onsterfelijk te maken en te verharden. Bron: SolitaryAnel (solitaritairangel) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Enkele van de bekende toepassingen voor dit metaal worden hieronder vermeld:
-Zijn zouten werden gebruikt voor het kleuren van katoen van oude theaters outfit.
-Gecombineerd met staal wordt het nog meer hard, zelfs in staat om mechanische sneden te weerstaan bij hoge snelheden.
-Tungsten sintering filamenten worden al meer dan honderd jaar gebruikt in elektrische bollen en gehalogeneerde lampen. Ook heeft het vanwege het hoge smeltpunt als materiaal geserveerd voor kathodestraalbuizen en voor raketmotoren -sproeiers.
-Vervangt lood bij de productie van projectielen en radioactieve schilden.
-Tungsten nanocables kunnen worden gebruikt in pH -gevoelige nanodispositief.
-Tungsten -katalysatoren werden gebruikt om de zwavelproductie in de olie -industrie aan te pakken.
-Wolfraamcarbide komt uit al zijn verbindingen die meer toepassingen dekt. Van de versterking van sneden en boorgereedschap, of de productie van stukken militaire bewapening, om hout, kunststoffen en keramiek te monteren.
Risico's en voorzorgsmaatregelen
Biologisch
Als een relatief zeldzaam metaal in de korst van de aarde, zijn de negatieve effecten schaars. In zure bodem kunnen polytungstaten de enzymen die worden gebruikt door molybdaten niet beïnvloeden; Maar in basisgronden, de wo42- Het komt wel (positief of negatief) in de metabole processen van de MOO in42- en koper.
De planten kunnen bijvoorbeeld de oplosbare verbindingen van wolfraam absorberen, en door ze een dier te eten en na hun vlees te consumeren, komen Watomen onze organismen binnen. De meeste worden uitgezet in urine en uitwerpselen, en er is weinig bekend wat er met de rest gebeurt.
Dierstudies toonden aan dat wanneer hoge concentraties wolfraampoeder symptomen ontwikkelen die vergelijkbaar zijn met longkanker.
Door inname zou een volwassen mens duizenden liter water moeten drinken verrijkt met wolfraamzouten om een aanzienlijke remming van colinesterase en fosfatase -enzymen te vertonen.
Fysiek
In het algemeen is Tungsten een klein giftig element, en er zijn daarom weinig hostrisico's voor gezondheidsschade.
Wat betreft metalen wolfraam, moet u vermijden om het stof te ademen; En als het monster solide is, moet rekening worden gehouden dat het erg dicht is en dat het fysieke schade kan veroorzaken als het valt of andere oppervlakken raakt.
Referenties
- Belwentelijkheid. (S.F.)). Tungsten (Wolfram): eigenschappen, productie, toepassingen en legeringen. De balans. Hersteld van: Thalance.com
- Wikipedia. (2019). Wolfraam. Opgehaald uit: in.Wikipedia.borg
- Lentech B.V. (2019). Wolfraam. Hersteld van: Lentech.com
- Jeff Desjardins. (1 mei 2017). De geschiedenis van wolfraam, het sterkste natuurlijke metaal op aarde. Hersteld van: VisualCapitalist.com
- Doug Stewart. (2019). Feiten voor wolfraam elementen. Hersteld van: chemicool.com
- Art Fisher en Pam Powell. (S.F.)). Wolfraam. Universiteit van Nevada. Hersteld van: unce.a r.Edu
- Helmestine, Anne Marie, pH.D. (2 maart 2019). Wolfraam- of wolfram -feiten. Hersteld van: Thoughtco.com

