Zwaveltrioxide (SO3) structuur, eigenschappen, risico's, gebruik
- 4206
- 922
- Irving McClure I
Hij Zwaveltrioxide Het is een anorganische verbinding gevormd door de vereniging van een zwavelatoom (s) en 3 zuurstofatomen (O). De moleculaire formule is zo3. Bij kamertemperatuur, de SO3 Het is een vloeistof die gassen in de lucht afgeeft.
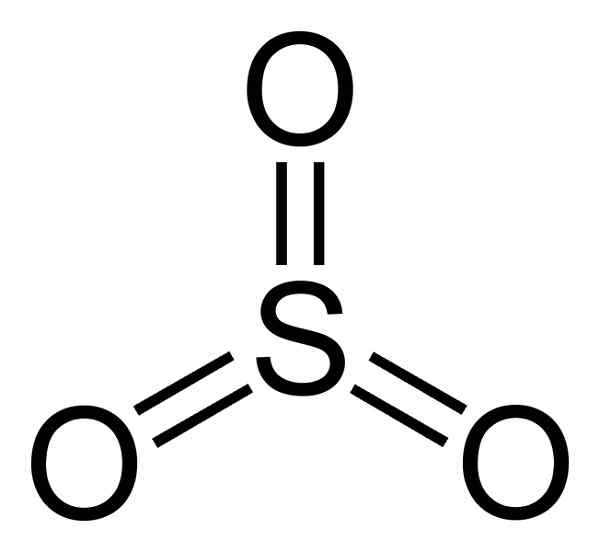
De structuur van de SO3 Gaseous is plat en symmetrisch. De drie zuurstof bevinden zich billijk rond de zwavel. De zo3 Reageert heftig met water. De reactie is exotherme, wat betekent dat warmte wordt geproduceerd, met andere woorden, veel wordt verwarmd.
 Zwaveltrioxidemolecuul dus3. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
Zwaveltrioxidemolecuul dus3. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. Wanneer de zo3 Vloeibare koelt, het wordt een vaste stof die drie soorten structuur kan hebben: alfa, bèta en gamma. De meest stabiele is de alfa, in de vorm van lagen samen met elkaar die een netwerk vormen.
Gaseous zwaveltrioxide wordt gebruikt om rokende zwavelzuur, ook wel olie genoemd, vanwege de olie- of vette substantie -gelijkenis te bereiden. Een andere van de belangrijke toepassingen is in de sulfonering van organische verbindingen, dat wil zeggen de toevoeging van groepen -So3- naar deze. Aldus kunnen nuttige chemicaliën worden bereid zoals wasmiddelen, kleurstoffen, pesticiden, onder vele anderen.
De zo3 Het is erg gevaarlijk, het kan ernstige brandwonden, ogen en huidschade veroorzaken. Het mag ook niet worden ingeademd of ingenomen omdat het de dood kan veroorzaken door interne brandwonden, in de mond, slokdarm, maag, enz.
Om deze redenen moet het met grote voorzichtigheid worden gemanipuleerd. U moet nooit contact opnemen met water of brandbare materialen zoals hout, papier, stoffen, enz., Nou, vuur kan worden geproduceerd. Het mag ook niet worden weggegooid of riolen vanwege het gevaar van explosie.
De zo3 Gasvormige gegenereerd in industriële processen mag niet worden vrijgegeven voor het milieu, omdat het een van degenen is die verantwoordelijk is voor zure regen die al grote uitbreidingen van bossen in de wereld heeft beschadigd.
[TOC]
Structuur
Het zwaveltrioxidemolecuul dus3 In gasvormige staat heeft het een platte driehoekige structuur.
Dit betekent dat zowel zwavel als drie zuurstof in hetzelfde vlak worden gevonden. Bovendien is de verdeling van zuurstof en alle elektronen symmetrisch.
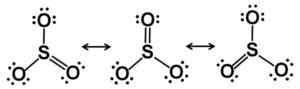 Lewis Resonance Starcutures. Elektronen zijn billijk verdeeld in de SO3. Auteur: Marilú Stea.
Lewis Resonance Starcutures. Elektronen zijn billijk verdeeld in de SO3. Auteur: Marilú Stea. In vaste toestand zijn er drie soorten soorten structuur bekend3: Alfa (α-SO3), bèta (β-SO3) en gamma (γ-SO3)).
De gamma-vorm γ-SO3 Bevat cyclische trimmers, dat wil zeggen drie eenheden van So3 samen een cyclische of ringvormige molecuul vormen.
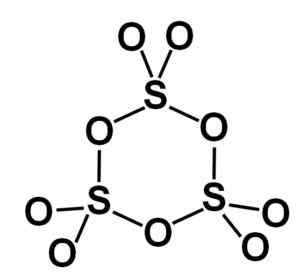 Ringmolecuul van het vaste zwaveltrioxide -type gamma. Auteur: Marilú Stea.
Ringmolecuul van het vaste zwaveltrioxide -type gamma. Auteur: Marilú Stea. De bèta β-so fase3 Het heeft oneindige spiraalvormige ketens van samenstelling tetrahedra dus4 verenigd met elkaar.
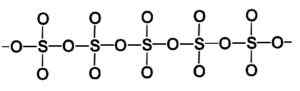 Structuur van een bèta van een vast zwaveltrioxide type. Auteur: Marilú Stea.
Structuur van een bèta van een vast zwaveltrioxide type. Auteur: Marilú Stea. De meest stabiele manier is alfa α-SO3, vergelijkbaar met bèta maar met een laagstructuur, waarbij de verenigde ketens een netwerk vormen.
Nomenclatuur
-Zwaveltrioxide
-Zwavelanhydride
-Zwaveloxide
-SW3 Gamma, γ-SO3
-SW3 Beta, β-SO3
-SW3 Alfa, α-SO3
Fysieke eigenschappen
Fysieke staat
Bij kamertemperatuur (ongeveer 25 ºC) en atmosferische druk, de SO3 Het is een kleurloze vloeistof die dampen in de lucht uitzendt.
Wanneer de zo3 Vloeistof is zuiver bij 25 ºC is een mengsel van So3 monomeer (een enkel molecuul) en trimere (3 gebonden moleculen) van formule S3OF9, ook wel zo genoemd3 Gamma γ-SO3.
Kan u van dienst zijn: Rankine Scale: wat is, conversies, voorbeeldenBij het verlagen van de temperatuur, als het zo is3 Het is puur wanneer het 16,86 ºC bereikt, het stolt of bevriest γ-SO3, ook wel "So Ice genoemd3".
Als het kleine hoeveelheden vocht (zelfs extreem kleine sporen of hoeveelheden) bevat,3 Polymeriseert de bèta β-SO3 die kristallen vormt met een zijdeachtige helderheid.
Dan worden meer vakbonden gevormd door de α-SO-structuur te genereren3, die een kristallijne vaste stof is in de vorm van naalden die lijkt op asbest of asbest.
Wanneer de alfa en bèta smelt gamma genereren.
Molecuulgewicht
80.07 g/mol
Smeltpunt
SW3 Gamma = 16.86 ºC
Drievoudige punt
Het is de temperatuur waarbij de drie fysieke toestanden aanwezig zijn: vast, vloeistof en gasvormig. In de alfa -vorm is het drievoudige punt op 62,2 ºC en in de bèta is het op 32,5 ºC.
Door de alfa -vorm te verwarmen, heeft dit een grotere neiging om sublimaliseren dan om te smelten. Sublimimar betekent rechtstreeks van de vaste toestand naar de frisdrank gaan, zonder door de vloeibare toestand te gaan.
Kookpunt
Alle vormen van zo3 Kook op 44,8 ºC.
Dikte
De zo3 Vloeistof (gamma) heeft een dichtheid van 1.9225 g/cm3 bij 20 ºC.
De zo3 Gaseous heeft een dichtheid van 2,76 ten opzichte van de lucht (lucht = 1), wat aangeeft dat deze zwaarder is dan de lucht.
Dampdruk
SW3 Alfa = 73 mm Hg bij 25 ºC
SW3 Beta = 344 mm Hg bij 25 ° C
SW3 Gamma = 433 mm Hg bij 25 ºC
Dit betekent dat de gamma -vorm de neiging heeft om gemakkelijker te verdampen dan de bèta en dit dat de alfa.
Stabiliteit
De alfabestand is de meest stabiele structuur, de andere zijn metastabiel, dat wil zeggen, ze zijn minder stabiel.
Chemische eigenschappen
De zo3 reageert energetisch met water om zwavelzuur h te geven2SW4. Bij het reageren is er zeer warmte zodat de waterdamp snel van het mengsel wordt losgemaakt.
Worden blootgesteld aan lucht de SO3 absorbeer snel vocht, die dichte dampen uitstraalt.
Het is een zeer sterk uitdrogende middel, dit betekent dat het water gemakkelijk uit andere materialen elimineert.
De zwavel van de SO3 Het heeft een affiniteit voor vrije elektronen (dat wil zeggen elektronen die geen verband tussen twee atomen bevinden), dus het heeft de neiging complexen te vormen met verbindingen die ze bezitten zoals pyridine, trimethylamine of dioxaan.
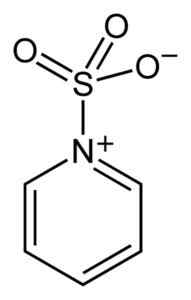 Complex tussen zwaveltrioxide en pyridine. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Complex tussen zwaveltrioxide en pyridine. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Door complexen te vormen, neemt Sulphur de elektronen van de andere verbinding "geleend" om hun gebrek hieraan te bevredigen. Zwaveltrioxide is nog steeds beschikbaar in deze complexen, die worden gebruikt in chemische reacties om dit te bieden3.
Het is een krachtig sulfonant reagens van organische verbindingen, wat betekent dat het dient om gemakkelijk een groep toe te voegen -zo3- Naar de moleculen.
Het reageert gemakkelijk met de oxiden van veel metalen om sulfaten van deze metalen te geven.
Het is corrosief in de richting van metalen, dieren- en plantenweefsels.
De zo3 Het is een moeilijk materiaal om om verschillende redenen te hanteren: (1) Het kookpunt is relatief laag, (2) heeft de neiging om vaste polymeren te vormen bij temperaturen van minder dan 30 ºC en (3) heeft een hoge reactiviteit voor bijna alle organische stoffen En het water.
Kan u van dienst zijn: amorfe vaste stoffen: structuur, eigenschappen, voorbeeldenHet kan explosief polymeriseren als het geen stabilisator bevat en er is vocht aanwezig. Als stabilisatoren worden dimethylsulfaat of booroxide gebruikt.
Het verkrijgen van
Het wordt verkregen door de reactie bij 400 ºC tussen het zwaveldioxide dus2 en moleculaire zuurstof of2. De reactie is echter erg langzaam en katalysatoren zijn echter vereist om de snelheid hiervan te verhogen.
2 Dus2 + OF2 ⇔ 2 Dus3
Onder de verbindingen die deze reactie versnellen, zijn de Platino Metal Pt, het vanadium pentoxide V2OF5, IJzeroxide2OF3 en stikstofoxide.
Toepassingen
In de oliebereiding
Een van de belangrijkste toepassingen bestaat uit de bereiding van olie- of rookzwavelzuur, genoemd omdat het zichtbare dampen naar het blote oog stoot. Om het te verkrijgen, wordt de SO geabsorbeerd3 In geconcentreerd zwavelzuur h2SW4.
 Pu -sulfuric oleum of roken. Je kunt de witte rook uit de fles zien komen. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Pu -sulfuric oleum of roken. Je kunt de witte rook uit de fles zien komen. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Dit gebeurt in speciale roestvrijstalen torens waar geconcentreerd zwavelzuur (dat vloeibaar is)3 Gaseous gaat omhoog.
Vloeistof en gas komen in contact en voegen zich aan, en vormt het oleum dat een olieachtige uiterlijk vloeistof is. Dit heeft een mengeling van h2SW4 En dus3, maar het heeft ook disulfurinezuurmoleculen h2S2OF7 en trisulfuric h2S3OF10.
In chemische sulfonatiereacties
Sulfonatie is een belangrijk proces in grootschalige industriële toepassingen voor de productie van wasmiddelen, oppervlakteactieve stoffen, kleurstoffen, pesticiden en farmaceutische producten.
De zo3 Het dient als een sulfonantmiddel om gesulfoneerde oliën en alkyl-angal gesulfoneerde wasmiddelen te bereiden, naast vele andere verbindingen. Hieronder is de sulfonatiereactie van een aromatische verbinding:
Arh + zo3 → Arso3H
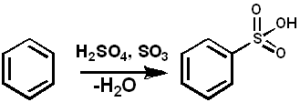 Benzeen sulfonatie met SO3. Pedro8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Benzeen sulfonatie met SO3. Pedro8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Voor sulfonatiereacties kunnen Oleum of zo worden gebruikt3 In de vorm van zijn complexen met onder andere pyridine of trimethylamine.
In metaalextractie
Gas s3 Het is gebruikt bij de behandeling van mineralen. Eenvoudige metaaloxiden kunnen veel meer oplosbare sulfaten worden bij het behandelen van deze3 Bij relatief lage temperaturen.
Zwavelmineralen zoals pyriet (ijzersulfide), kanaal3 Laat deze metalen gemakkelijk en tegen lage kosten toe.
IJzer-, nikkel- en kopersulfiden reageren met zo gas3 Zelfs bij kamertemperatuur, het vormen van de respectieve sulfaten, die zeer oplosbaar zijn en kunnen worden onderworpen aan andere processen om zuiver metaal te verkrijgen.
In verschillende toepassingen
De zo3 Het dient om chlorosulfurinezuur te bereiden, ook wel chlorosulfonzuur hso genoemd3Klet.
Zwaveltrioxide is een zeer krachtig oxidatiemiddel en wordt gebruikt in explosieve productie.
Risico's
Tot de gezondheid
De zo3 Het is een zeer giftige verbinding door alle routes, dat wil zeggen inademing, inname en huidcontact.
Irrita en corrodeen slijmvliezen. Veroorzaakt huid en ogen. Zijn dampen zijn erg giftig wanneer ze worden ingeademd. Interne brandwonden worden geproduceerd, ademhalingsmoeilijkheden, pijn op de borst en longoedeem op de borst.
Kan u van dienst zijn: butanone: structuur, eigenschappen en gebruik Zwaveltrioxide SO3 is erg corrosief en gevaarlijk. Auteur: Openicons. Bron: Pixabay.
Zwaveltrioxide SO3 is erg corrosief en gevaarlijk. Auteur: Openicons. Bron: Pixabay. Het is giftig. De inname genereert ernstige verbranding, slokdarm en maag. Bovendien wordt vermoed dat het carcinogeen is.
Vuur of explosie
Het vertegenwoordigt brandgevaar wanneer ze in contact komen met organische materialen zoals hout, vezels, papier, olie, katoen, vooral als ze nat zijn.
Er is ook risico als u in contact komt met bases of reducerende agenten. Het wordt explosief gecombineerd met water en vormt zwavelzuur.
Contact met metalen kan waterstofgas H produceren2 die erg ontvlambaar is.
Het moet worden vermeden in glazen vaten om mogelijke gewelddadige breuk van de container te voorkomen.
Milieu -impact
De zo3 Het wordt beschouwd als een van de grootste verontreinigende stoffen die aanwezig zijn in de atmosfeer van de aarde. Dit is te wijten aan zijn rol bij de vorming van aerosolen en zijn bijdrage aan zure regen (vanwege de vorming van zwavelzuur H2SW4)).
 Bos beschadigd door zure regen in Tsjechië. Lovecz [Public Domain]. Bron: Wikimedia Commons.
Bos beschadigd door zure regen in Tsjechië. Lovecz [Public Domain]. Bron: Wikimedia Commons. De zo3 Het wordt in de atmosfeer gevormd vanwege de oxidatie van zwaveldioxide dus2. Wanneer de SO wordt gevormd3 Dit reageert snel met water om zwavelzuur H te vormen H2SW4. Volgens recente studies zijn er andere SOS -transformatiemechanismen3 In de atmosfeer, maar vanwege de grote hoeveelheid water die in deze aanwezig is, wordt de SO nog steeds overwogen3 Voornamelijk geconverteerd naar h2SW4.
De zo3 gas- of industrieel gasvormige afval dat het bevat, mag niet naar de sfeer worden gedownload omdat het een gevaarlijke verontreiniging is. Het is een extreem reactief gas en, zoals hierboven al is gezegd, in aanwezigheid van vocht van de lucht de SO3 Het wordt zwavelzuur h2SW4. Daarom, in de lucht3 blijft bestaan in de vorm van zwavelzuur die kleine druppeltjes of aerosol vormt.
Als zwavelzuurdruppeltjes het luchtwegkanaal van de mens of dieren binnenkomen, groeien ze snel door vocht dat daar aanwezig is, dus hebben ze de mogelijkheid om de longen binnen te dringen. Een van de mechanismen door de zure mist van h2SW4 (dat is zo3) Het kan een sterke toxiciteit veroorzaken, is omdat de extracellulaire en intracellulaire pH van levende organismen (planten, dieren en mens) veranderingen verandert).
Volgens sommige onderzoekers, dus mist3 Het is de oorzaak van de toename van de astmapatiënten in een gebied van Japan. De mist van zo3 Het heeft een zeer corrosief effect op metalen, dus de metaalstructuren die door de mens zijn gebouwd, zoals sommige bruggen en constructies kunnen zeer worden beïnvloed.
De zo3 Vloeistof mag niet worden weggegooid in de afwatering van vuile wateren of riolen. Als het in de riolen wordt gegoten, kunt u brand of explosie maken. Als het per ongeluk wordt gemorst, mag een stroom water niet op het product worden gericht. Het mag nooit worden opgenomen in zaagsel of andere absorberende brandstof, omdat het branden kan genereren.
Het moet worden geabsorbeerd in droog zand, droge land of andere volledig droge inerte absorberende. De zo3 Het mag niet in de omgeving worden gegoten en mag hier nooit contact mee opnemen. Het moet ver van waterbronnen worden gehouden omdat hiermee zwavelzuur produceert dat schadelijk is voor water- en landorganismen.
Referenties
- Sarkar, s. et al. (2019). Invloed van ammoniak en water op het lot van zwaveltrioxide in de troposfeer: theoretisch onderzoek van sulfaminezuur- en zwavelzuurvormingsroutes. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI hersteld.NLM.NIH.Gov.
- Muller, T.L. (2006). Zwavelzuur en zwaveltrioxide. Kirk-othmer encyclopedie van chemische technologie. Deel 23. Opgehaald uit de online bibliotheek.Wiley.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Trioxide zwavel. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Kikuchi, r. (2001). Milieubeheer van zwaveltrioxide Imission: impact van So3 Over de menselijke gezondheid. Milieubeheer (2001) 27: 837. Link hersteld.Springer.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Ismail, m.Je. (1979). Extractie van metalen uit sulfiden met behulp van zwaveltrioxide in gefluidiseerd bed. J. Chem. Technisch. Biotechnol. 1979, 29, 361-366. Opgehaald uit de online bibliotheek.Wiley.com.
- « Malawi Lago Geography, Geology, Belang, Fauna, Rios
- Natriumcyanide (NACN) structuur, eigenschappen, risico's, gebruik »

