Döbereiner triaden
- 2702
- 131
- Miss Herman Russel
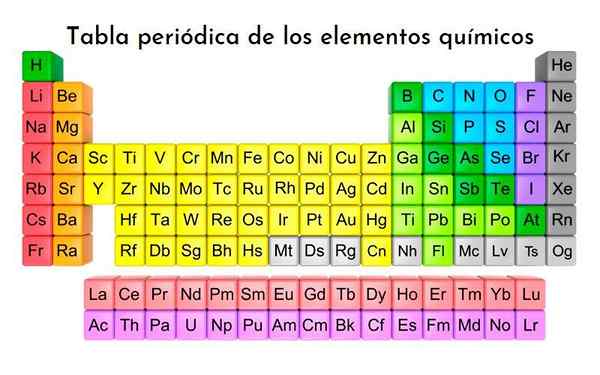
 Periodiek systeem van de elementen, alle tot nu toe ontdekte chemische elementen zijn geclassificeerd. Met licentie
Periodiek systeem van de elementen, alle tot nu toe ontdekte chemische elementen zijn geclassificeerd. Met licentie Wat zijn de triaden van Döbereiner?
De Döbereiner triaden Ze zijn het eerste experiment waarbij drie chemische elementen werden gegroepeerd die vergelijkbare kenmerken delen, waardoor ze worden geassocieerd met hun atoomgewichten. Maken deel uit van de 118 chemische elementen, die de diversiteit van getoonde reacties zijn en hun verbindingen hun meest opvallende uiterlijk.
Het idee om de elementen te classificeren is om hun chemische eigenschappen goed aan te pakken zonder een reeks regels en theorieën te ontwikkelen voor elk van hen.
De periodieke classificatie heeft een enorm nuttig systematisch raamwerk gegeven om ze te correleren volgens enkele zeer eenvoudige en logische patronen.
De elementen zijn systematisch gerangschikt in rijen en kolommen met toenemende atoomnummers en de ruimte voor nieuwe ontdekkingen is gereserveerd.
In 1815 waren slechts ongeveer 30 elementen bekend. Hoewel er veel informatie over deze en hun verbindingen beschikbaar was, was er geen duidelijke volgorde.
Er werden verschillende pogingen gedaan om de bestelling te vinden, maar het was moeilijk.
Ontdek van de triaden van Döbereiner
Wetenschapper Johann Wolfgang Döbereiner (1780-1849) maakte belangrijke bevindingen over numerieke regelmaat bij de atoomgewichten van de elementen. Hij was de eerste die het bestaan opmerkte van verschillende groepen van drie elementen, die hij triaden noemde, die chemische overeenkomsten vertoonden.
Deze elementen onthulden een belangrijke numerieke relatie, omdat eenmaal besteld volgens hun equivalent of atoomgewicht, het gewicht van het centrale element het geschatte gemiddelde van de twee resterende elementen in de triade bleek te zijn.
Kan u dienen: natriumfosfaat: structuur, eigenschappen, synthese, gebruikIn 1817 ontdekte Döbereiner dat als bepaalde elementen werden gecombineerd met zuurstof in binaire verbindingen, een numerieke relatie kon worden onderscheiden tussen de equivalente gewichten van deze verbindingen.
Dus wanneer calcium-, strontium- en bariumoxiden werden beschouwd, was het equivalent gewicht van strontiumoxide ongeveer het gemiddelde van calciumoxide en bariumoxide. Er wordt gezegd dat de drie elementen in kwestie, strontium, calcium en barium, een triade vormen.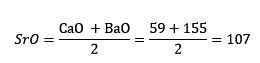
Hoewel Döbereiner werkte met peso's die waren afgeleid uit weinig rigoureuze experimentele methoden, maar voor die tijd van kracht, zijn hun waarden nauwlettend goed.
De observatie van Döbereiner had weinig invloed op de chemische wereld, maar werd toen zeer invloedrijk. Momenteel wordt het beschouwd als een van de pioniers van de ontwikkeling van het periodieke systeem.
Twaalf jaar later, in 1829, voegde Döbereiner drie nieuwe triaden toe, die hieronder worden getoond:
Halogeengroep
Chloor, broom en jodium hebben vergelijkbare chemische eigenschappen en vormen een triade. Deze elementen zijn zeer reactieve metalen. Als ze worden vermeld in de volgorde van toenemende relatieve massa, zijn ze in de volgorde van afnemende reactiviteit. Bromo heeft een tussenliggende atoommassa tussen chloor en jodium.

De atoommassa van de gemiddelde broom.
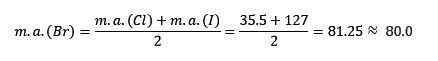
De verkregen gemiddelde waarde ligt dicht bij de atoommassa van broom (BR).
Overeenkomsten in chemische eigenschappen:
1. Het zijn allemaal niet -metalen.
2. Ze reageren allemaal met water om zuren te vormen (bijvoorbeeld in: HCl, HBR, HF).
Het kan u van dienst zijn: Biodiesel: geschiedenis, eigenschappen, typen, voor-, nadelen3. Iedereen heeft een Valencia van één (bijvoorbeeld in: HCl, HBR, HF).
4. Ze reageren allemaal met alkalische metalen om neutrale zouten te vormen (bijvoorbeeld NaCl, Nabab, NAI)
Alkalische metaalgroep
Lithium, natrium en kalium hebben vergelijkbare chemische eigenschappen en vormen een triade. Deze elementen zijn zacht en licht maar zeer reactieve metalen.
Als ze worden vermeld in de volgorde van toenemende relatieve atoommassa, zijn ze ook in een volgorde van toenemende reactiviteit. Natrium heeft de tussenliggende atoommassa tussen lithium en kalium.

De atoommassa van het centrale element natrium (NA) is gelijk aan het gemiddelde van de lithium -atomaire massa (Li) en kalium (k).
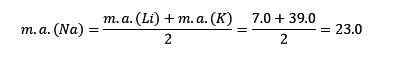
Overeenkomsten in chemische eigenschappen:
1. Het zijn allemaal metalen.
2. Alles reageren met water om alkalische oplossingen en waterstofgas te vormen.
3. Iedereen heeft een Valencia de One (bijvoorbeeld in: LiCl, NaCl, KCL).
4. De carbonaten zijn bestand tegen thermische ontleding.
Groep van calcogenen of amfumo's
Zwavel, selenium en teluro hebben vergelijkbare chemische eigenschappen en vormen een triade. Het selenium heeft de tussenliggende atoommassa tussen zwavel en teluro.

De atoommassa van het gemiddelde seleniumelement (SE) is gelijk aan de gemiddelde atoommassa's van zwavel (s) en Teluro (TE).
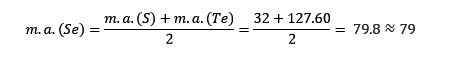
Nogmaals, de verkregen gemiddelde waarde ligt dicht bij het atoomdeeg van selenium (SE).
Overeenkomsten in chemische eigenschappen:
1. De combinaties met hydrogenen van deze elementen resulteren in giftige gassen.
2. Elk van deze elementen heeft 6 valentie -elektronen.
3. Metaalkwaliteiten nemen toe naarmate het atoomnummer toeneemt.
Döbereiner waarschuwde ook dat om geldige te zijn, triaden chemische relaties tussen de elementen moesten onthullen, evenals numerieke relaties.
Het kan u van dienst zijn: kaliumchloraat (KCLO3)Aan de andere kant weigerde hij om fluoride te groeperen samen met chloor, broom.
Hij was ook terughoudend om het uiterlijk van triaden tussen ongelijksoortige elementen, zoals stikstof, koolstof en zuurstof, te overwegen, hoewel ze een significante triadische numerieke relatie vertoonden.
Het werk van Döbereiner was gericht op de relaties tussen de elementen van een triade, maar gaf geen idee over de relatie tussen hen.
Het is voldoende om te zeggen dat het onderzoek van Döbereiner het idee van triaden heeft vastgesteld als een krachtig concept, dat verschillende andere chemicaliën snel rekening zouden houden.
In feite vertegenwoordigden Döbereiner -triaden de eerste stap om de elementen te groeperen in verticale kolommen in de periodieke tabel en zo een systeem op te zetten dat de chemische eigenschappen verklaart en de fysieke relaties van de elementen onthult.
Uitbreiding van triaden
Andere chemicaliën verlengden de triaden van Döbereiner om meer op te nemen dan de oorspronkelijke drie elementen. Fluoride werd bijvoorbeeld toegevoegd aan de bovenkant van de triade die chloor, broom en jodium bevatte.
Er zijn andere "triaden" opgetreden, zoals een triaden die zuurstof, zwavel, selenium en Telurio bevatten. Maar er was geen systeem om ze als een geheel te correleren.
Een van de belangrijkste ongemak was dat veel relatieve atoommassa's voor die tijd nog steeds verkeerd waren.
Referenties
- Johann Wolfgang Döbereiner. Hersteld uit Britannica.com.
- Wat is groep 16 van het periodieke tabel? Hoe worden die elementen gebruikt? Hersteld van Quora.com.

