Koolstofatoom
- 4779
- 1298
- James Dach
We leggen uit wat het koolstofatoom is, de elektronische structuur, kenmerken en orbitale hybridisatie.
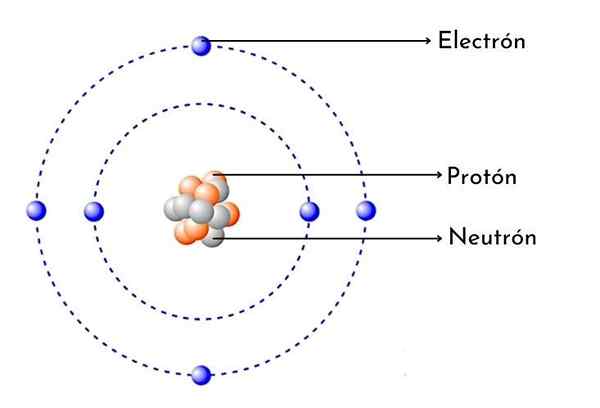
 Koolstofatoomschema
Koolstofatoomschema Wat is koolstofatoom?
Koolstof is element nummer 6 van de periodiek systeem en is een van de belangrijkste elementen die bestaan. Het belang ervan komt voort uit een zeer rijke en gevarieerde chemie die dit element laat vormen Basis van het leven op de planeet Aarde, zoals we weten.
Het is ongeveer een niet-metaal behorend bij Groep 14 van het periodiek systeem (voorheen Groep 4A) en de tweede periode. In zijn natuurlijke vorm wordt het geassocieerd met steenkool (zowel mineraal als groente) en de roet, waarin het voornamelijk in de vorm van grafiet of andere alotrope is.
Hij Koolstofatoom Het is een van de kleinste van het periodiek systeem. Het is een tetravalent atoom, dat wil zeggen het kan vormen Maximaal vier links met andere atomen gelijk of verschillend van hetzelfde.
Koolstof is van groot belang voor mensen. Het is een van de belangrijkste componenten van ons lichaam en vormt meer dan 19% van zijn massa. Bovendien heeft het ook meerdere technologische toepassingen afgeleid van zijn atomaire eigenschappen.
Kenmerken van het koolstofatoom
- Het koolstofatoom is een niet -metaal: Koolstof is een niet -metalen element dat kan worden gecombineerd met vele andere elementen van het periodiek systeem. Koolstofatomen kunnen respectievelijk andere atomen aan andere atomen verwerven of geven, respectievelijk anionen of kationen worden.
- Het heeft 6 protonen in zijn kern: Het atoom aantal koolstof is 6, wat betekent dat het 6 protonen in zijn kern heeft. Het betekent ook dat een neutraal koolstofatoom 6 elektronen rond de kern heeft.
Kan u van dienst zijn: magnetische scheiding- Het hoort bij blok P van het periodiek systeem: De elektronische koolstofconfiguratie in zijn fundamentele staat is 1s2 2s2 2 p2. Zoals te zien is, bevinden de laatste Valencia -elektronen zich in P -orbitalen, dus de koolstof behoort tot blok P van het periodiek systeem.
- De valenties van het koolstofatoom zijn +2, +4 en -4: De koolstofvalentielaag ontbreekt slechts 4 elektronen om volledig te vullen en zo de elektronische configuratie van nobel neongas te verwerven. Om deze reden kan koolstof het carbide -anion vormen, c4-, die 4 elektronen meer heeft dan neutrale koolstof. Aan de andere kant kan het koolstofatoom ook de twee 2p -elektronen verliezen, waardoor het koolstofkation wordt (c2+), of alle 4 elektronen in Valencia, die het koolstofkation worden (c4+)).
- U kunt meerdere alotropen vormen: Elementaire koolstof kan worden gevonden in twee gemeenschappelijke natuurlijke vormen die grafiet en diamant zijn, die radicaal tegenovergestelde eigenschappen hebben. Bovendien kun je verschillende jongens, koolstof- en grafeen -nanobuisjes vormen.
De drie isotopen van het koolstofatoom
Alle koolstofatomen hebben zes protonen in hun kern, maar niet allemaal hebben hetzelfde aantal neutronen, wat leidt tot drie isotopen:
- Koolstof-12 (12C): Het is de meest stabiele en overvloedige (ongeveer 98,9%). Het heeft 6 neutronen in zijn kern.
- Koolstof-13 (13C): Het heeft 7 neutronen.
- Koolstof-14 (14C): Het is radioactieve toepassingen voor de data van oude objecten.
Elektronische structuur van het koolstofatoom
Zoals elk koolstofatoom, heeft het zes positieve protonen in zijn kern, dan heeft het ook 6 elektronen met negatieve belasting omdraaien.
Kan u van dienst zijn: aliquot (chemie)De manier waarop deze elektronen worden verdeeld of de elektronische configuratie van het koolstofatoom is:
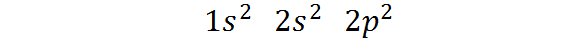
Deze elektronische configuratie geeft dat aan Koolstof heeft 2 elektronen in de 1s orbital, Twee elektronen in orbitale 2s, En twee elektronen verdeeld over de drie orbitalen 2p.
Aan de andere kant is de valentielaag voor koolstof de laag L, die overeenkomt met niveau n = 2, omdat het de hoogste niveau -laag is die elektronen bevat. Zoals we kunnen zien, heeft koolstof in totaal 4 elektronen op niveau 2, Dus we zeggen dat Het heeft 4 Valencia -elektronen.
Dit is de reden waarom de koolstof zich bevindt waarin deze eerder groep 4A van het periodiek systeem werd genoemd.
Atomaire orbitale hybridisatie in het koolstofatoom
Atomen reageren en koppelen aan elkaar via hun valentie -elektronen en de orbitalen die ze bezetten. Deze laatste hebben echter niet altijd voldoende oriëntatie om de nodige links te vormen.
De link -theorie van Valencia stelt dat atomen hun atomaire orbitalen combineren om nieuwe hybride orbitalen te vormen die de juiste begeleiding hebben. Dit proces wordt genoemd hybridisatie.
Afhankelijk van het aantal atomen waaraan een koolstofatoom is gekoppeld, zal het een ander aantal pure atoom orbitalen mengen of hybridiseren. Dit geeft aanleiding tot Drie verschillende hybridisaties, Wat zijn ze:
SP
Treedt op wanneer koolstof alleen is gekoppeld aan Twee atomen. In dit geval zijn de orbitale S met een van de drie p -orbitalen gemengd, wat aanleiding geeft tot twee sp orbitalen die in tegengestelde richtingen wijzen (180º van elkaar).
Kan u van dienst zijn: Mercury BarometerDe twee p -orbitalen die zonder mengen worden overgelaten, worden gebruikt om PI -bindingen te vormen. Koolstofatoom kan zich vormen Een drievoudige link (die twee PI -bindingen bevat) met een enkel atoom, of kan vormen Twee dubbele links, één met elk atoom (en met elk een link PI).
SP2
Als koolstof wil meedoen Drie atomen, U hebt drie hybride orbitalen nodig, dus meng drie pure orbitalen: de orbitale s en twee orbitalen P. Dit genereert drie SP hybride orbitalen2 dat punt naar de hoeken van een gelijkzijdige driehoek.
De orbitale P die niet werd gebruikt, kan een PI -link vormen met een van de drie gekoppelde atomen, wat aanleiding geeft tot een dubbele binding.
SP3
Wanneer koolstof naar links gaat Vier atomen, Meng de 4 pure orbitalen van uw valentielaag om 4 hybride orbitale SP te genereren3. Deze wijzen op de hoekpunten van een gewone tetraëder.
Omdat er geen orbitalen zijn om PI -bindingen te vormen, een koolstof met SP -hybridisatie3 U kunt slechts vier eenvoudige links vormen en geen meervoudige link.
Referenties
- Britannica, de redactie van Encyclopaedia. Koolstof - feiten, gebruik en eigenschappen. Genomen van https: // www.Britannica.com/science/carbon-chemisch element
- Wereldwijd monitoringlaboratorium. (S. F.)). Koolstofcyclus broeikasgassen. Genomen van https: // gml.NOAA.Gov/ccg/isotopen/chemie.HTML

