Tiolen
- 3763
- 559
- Lonnie Rohan
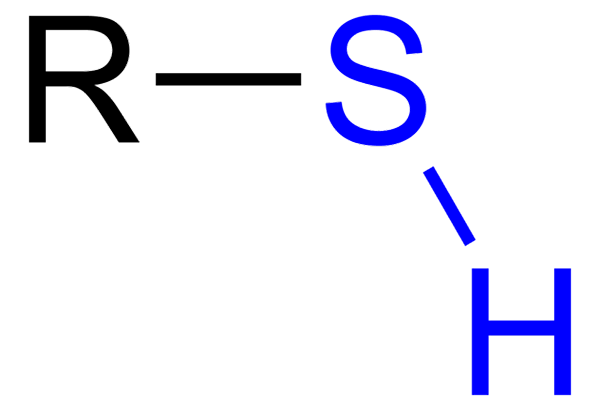
De Tiolen Het zijn organische verbindingen met een SH -groep, genaamd Tiol of Sulfihydrilo Group. De algemene formule is RSH en kan R vertegenwoordigen aan een huur, een aryl of andere chemische groep. Het onderscheidende kenmerk van thiolen is de sterke stinkende geur.
Sommige thiolen worden gebruikt om hun geur van brandbare gassen te geven, om een lekkage van deze gassen te detecteren, die hun kenmerk van groot gevaar kan zijn. Tioles zijn vergelijkbaar met alcoholen, omdat ze een OH -groep hebben, terwijl de thiolen een sh.
 Tiol met blauwe sulfhydrillo -groep
Tiol met blauwe sulfhydrillo -groep Ze hebben op hun beurt echter verschillende verschillen: de OH -groep is meer polair dan de SH -groep, en zwavel is een kleiner atoom dan zuurstof en minder elektronegatief.
Dit bepaalt dat thiolen moleculen niet waterstofbruggen of water of onder hen vormen. Daarom is de oplosbaarheid van thiolen in het water laag en is het kookpunt lager dan die van alcoholen met een keten van vergelijkbare koolstofatomen.
Tioles zijn vooral nuttig en frequent in biochemische systemen, omdat verschillende overeenkomen met biomoleculen, zoals co -enzym tot. De S-H-binding is zuurder dan O-H, gemakkelijker te breken, en ook gemakkelijker te vervangen of vervangen van andere moleculaire fragmenten in tal van zwavel-organische synthese.
[TOC]
Tioles eigenschappen
 Het stinkende aroma van de uitlopers bestaat voornamelijk uit thiolen
Het stinkende aroma van de uitlopers bestaat voornamelijk uit thiolen Algemeenheid
De OH -groep alcoholen en de SH -groep van de tioles delen een reeks fysische en chemische eigenschappen voor het behoren van zuurstof en zwavel aan dezelfde chemische groep van de periodiek systeem (via groep).
Loa tioéters, uniocetals en thioésters, die analoog zijn aan chemische verbindingen gevormd door alcoholen, zoals ethers, acetalen en esters. S-H en O-H-links presenteren echter enkele verschillen die worden weerspiegeld in de eigenschappen van thiolen en alcoholen.
Geur
Een kenmerk van thiolen met een laag molecuulgewicht is de onaangename geur, vergelijkbaar met knoflook en ui. Deze geur is van zo grootheid dat de menselijke geur een drempel heeft van een deel van het thiol voor tien miljard delen van lucht.
Etanotiol wordt toegevoegd aan aardgas als veiligheidsmaatregel, om elke ontvlambare maar toilet te detecteren. De geur van thiolen neemt af door het aantal koolstofatomen van hun ketting te vergroten, omdat de volatiliteit en het aandeel van tiol zwavel afnemen.
Kan u van dienst zijn: ammoniumfosfaat: structuur, eigenschappen, verkrijgen, gebruikKookpunt en oplosbaarheid
De S-H-link van de Thioles heeft een dipoolmoment minder dan de O-H-link van de alcoholen. Bovendien is het zwavelatoom kleinere en kleinere elektronegativiteit dan het zuurstofatoom.
Dit bepaalt dat thiolen moleculen niet waterstofbruggen met water of tussen hen kunnen vormen, wat een verschil veroorzaakt tussen de fysische eigenschappen van thiolen en alcoholen. Bijvoorbeeld: metanotiol (cho3SH) heeft een kookpunt van 6 ºC, terwijl methanol (cho3Oh) kookt op 65 ° C.
Daarom is methanol bij kamertemperatuur (25 ºC) een vloeistof en is metanotiol een gas.
Samenvattend: Thioles hebben een lager kookpunt dan de overeenkomstige alcoholen gepresenteerd. Om dezelfde redenen is de oplosbaarheid van thiolen in het water en in andere polaire oplosmiddelen erg laag. Ondertussen zijn alcoholen met een laag molecuulgewicht zeer oplosbaar in water.
Reactiviteit
De S-H-link is zwakker dan de O-H-binding, dus Link S-H dissocieert gemakkelijker, waardoor thiolen sterke zuren zijn dan alcoholen. De meeste alcoholen hebben een PKA tussen 16 en 18, terwijl thiolen een PKA hebben rond 11.
Dit maakt thiolen mogelijk-): Een zeer sterk nucleofiel middel.
De SH-groep kan oxideren om disulfidenverbindingen (-s-s-) te vormen die aanwezig zijn in glutathionische oxidatie: een thiol aanwezig in cellen en heeft een antioxiderende functie.
Bromo of andere halogenen, evenals zuurstof, kunnen op een thiol werken om disulfur -bruggen te vormen:
2 RSH +Br → R-S-S-R '+2 HBR
RSSR 'verbindingen staan bekend als organische sulfiden en alkiiles, r2S.
Aan de andere kant kunnen sterke oxidatiemiddelen, zoals natriumhypochloriet en waterstofperoxide, werken op thiolen om sulfonzuren te veroorzaken:
Rsh +h2OF2 → RSO3H +3 H2OF
Nomenclatuur
De IUPAC -nomenclatuur voor thiolen lijkt erg op die van alcoholen: de naam van de alkano waaruit het achtervoegsel 'tiol' aan hem wordt toegevoegd.
Zo wordt bijvoorbeeld de van de stano-afgeleide distan 1-butanotiol, CH genoemd3Ch2Ch2Ch2SH, die met het nummer de positie van de SH -groep in de koolstofatomen van de ketting aangeeft.
Kan u van dienst zijn: kation: training, verschillen met anion en voorbeeldenOp dezelfde manier is er nog een nomenclatuur, nogmaals, vergelijkbaar met die van alcoholen: het woord 'alcohol' wordt vervangen door 'mercaptan' in de namen van alcoholen. Bijvoorbeeld cho3SH, analoog aan methylalcohol, ch3Oh, wordt methyl of mercaptan mercaptan genoemd.
Een ander voorbeeld zou cho zijn3Ch2CH (SH) CH3, genaamd 2-butanotiol, Secbutilic Merchant of Merchandise Secbutil. Dat wil zeggen, de nadruk wordt gelegd op de identiteit van R in de RSH -formule. Daarom worden ook de andere normen van de nomenclatuur voor alcoholen vervuld voor thiolen.
En ten slotte, wanneer de SH -groep aanwezig is in een grotere structuur of waar de belangrijkste groepen overheersen, wordt het sulfihydrilo of mercapto -voorvoegsel gebruikt.
Bijvoorbeeld samengestelde ch3Ch2CH (SH) Coch3 Het wordt 3-Mercapto-2-Penona genoemd. Merk op dat de SH minder prioriteit heeft dan geoxygeneerde groepen (behalve de ether), dus kleine cijfers komen eraan.
Synthese
Een methode van synthese van thiolen bestaat uit de reactie van de tiota met een alkylhalide, dat een tussenliggend zout van isotiouron produceert. Dit wordt gehydrolyseerd door natriumhydroxide om thiol en ureum te verkrijgen.
De ch3SH wordt industrieel bereid door reactie van waterstofsulfide met methanol, in aanwezigheid van zure katalysatoren:
Ch3OH +H2S → CH3SH +H2OF
In een andere productiemethode wordt een alkylhalogenide gereageerd met natriumhydrosulfuro:
RX +NASH → RSH +NAX
Toepassingen
Enzymbevestiging gekoppeld aan nanodeeltjes
Tioles worden gebruikt als bruggen om nanoparticula-enzymcomplexen aan te sluiten bij gouden elektroden. Thiolen worden bijvoorbeeld gebruikt voor de fixatie van het nanodeeltje-uricasa-complex, een enzym dat tussenbeide komt in de omzetting van urinezuur in allantoine.
Tiol -geen reactie
Het is een organische reactie tussen een tiol en een alkeen, die een "klik" -reactie oproept; Dat het onder andere een hoge prestatiereactie, brede reikwijdte is, die elimineerbaar creëert door -producten door niet -chromatografische methoden, en dat is ook gemakkelijk uit te voeren.
De thiol -geen reactie heeft toepassingen in de synthese van tioazúcar: suiker aanwezig in salicinol, een a -glycosidaseremmer. Salicinol is geïsoleerd uit planten die in Sri Lanka en India worden gebruikt bij de behandeling van diabetes.
Bovendien wordt de thiol -geen reactie gebruikt in de chemie van koolhydraten, polymerisaties, oppervlaktechemie, synthesechemie en chemie van peptiden.
Kan u van dienst zijn: vriespunt: hoe u het kunt berekenen en voorbeeldenGeurstoffen
 Het keukengas is toilet, maar dankzij de samenstelling van thiolen met een laag molecuulgewicht heeft het een onderscheidende geur
Het keukengas is toilet, maar dankzij de samenstelling van thiolen met een laag molecuulgewicht heeft het een onderscheidende geur Alifatische thiolen van laag molecuulgewicht worden opgenomen in natuurlijke gassen, zodat hun sterke geur dient als een waarschuwing in het gezicht van een ontsnapping of lekkage van gas.
Geneesmiddel
Penicilamine (c5HelfNEE2S) Het is een medicijn dat wordt gebruikt bij de behandeling van de ziekte van Wilson en reumatoïde artritis.
En de captopril (c9HvijftienNEE3S) Aan de andere kant wordt het gebruikt bij de behandeling van arteriële hypertensie en in congestieve hartziekten.
Beide zijn voorbeelden van thiolen met medicinale toepassingen.
Biologisch
Tiolesgroepen zijn aanwezig, onder andere verbindingen met biologische functie, in cysteïne, co -enzym A en glutathion.
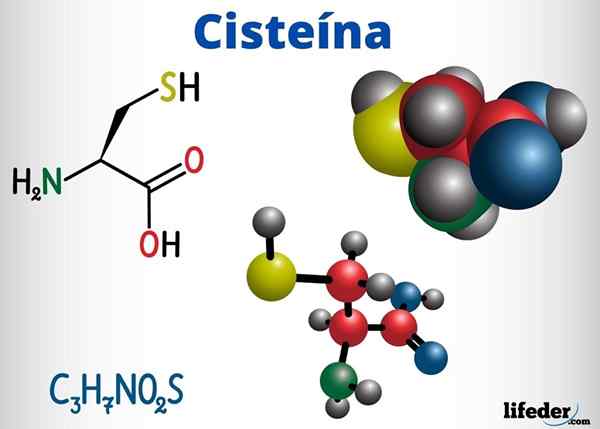
Cysteïne is een aminozuur dat in staat is om disulfurbruggen in zijn eiwitketen te vormen, daarom, verantwoordelijk voor de tertiaire structuur van een eiwit. Het kan ook disulfurbruggen vormen tussen verschillende eiwitketens, waardoor de quaternaire structuur van eiwitten wordt veroorzaakt.
Cysteïne bevindt zich in de actieve centra van talloze enzymen en heeft ook een antioxidantactie.
Glutathion is een zeer belangrijke antioxiderende intracellulaire werking, die bescherming biedt aan cellen en macromoleculen die het samenstellen.
Co -enzym A, daarentegen, is een thiol die tussenbeide komt in de synthese en oxidatie van vetzuren. Bovendien komt co -enzym onder de vorm van acetylcoenzyme A in aan het begin van de citroenzuurcyclus of Krebs -cyclus.
Voorbeelden
Ten slotte zullen enkele namen van thiolen worden vermeld, vergezeld van hun moleculaire formules:
-Tioazijnzuur (c2H4JIJ)
-Co -enzym a (ceenentwintigH36N7OF16P3S)
-Verminderde glutatie (c10H17N3OF6S)
-Cysteïne (c3H7NEE2S)
-Mercaptanol (c2H6JIJ)
-Metanotiol (ch3SH)
-1-propanotiol (c3H7SH)
-Butanotiol (c4H 9SH)
-Tiofenol of tiomerosal (c6H6S)
-Pomelo Mercaptano (C10H18S)
-Hexadecanotiol (c6H3. 4S)
-Penicillamine (c6HelfNEE2S)
-Captopril (c9HvijftienNEE3S)
-Etanotiol (c2H6S)
-2-propenetiol (c3H6S)
-Α-lipoïsche of lipoamide (c8H14OF2S2)). Het is een cyclische disulfide.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Thiol. Opgehaald uit: in.Wikipedia.borg
- Dr. Dietmar Kennepohl et al. (13 september 2020). Thiols en sulfiden. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Thiol. Hersteld van: Britannica.com
- Nolan MD en Scanlan EM (2020) Toepassingen van thiol-een chemie voor peptidewetenschap. Voorkant. Chem. 8: 583272. Doi: 10.3389/fchem.2020.583272
- Dr. Carl C. Wamboers. (1999). Hoofdstuk 9: Alcoholen en thiolen. Opgehaald uit: Web.Pdx.Edu

