Ethylether

- 3860
- 237
- Lonnie Rohan
 De ethylether is een vluchtige en brandbare vloeistof die in de negentiende eeuw als anesthetisch diende
De ethylether is een vluchtige en brandbare vloeistof die in de negentiende eeuw als anesthetisch diende Wat is ethylether?
Hij ethylether, Ook bekend als Dietyl Ether, is het een organische verbinding waarvan de chemische formule C is4H10OF. Het wordt gekenmerkt door een kleurloze en vluchtige vloeistof te zijn, en daarom moeten de flessen zo strak mogelijk worden gesloten.
Deze ether. Dat wil zeggen, ze hebben de ROR -formule ', waarbij r en r' verschillende koolzuurhoudende segmenten vertegenwoordigen. En zoals beschreven door de tweede naam, Dietyl Ether, zijn twee radicalen -ethyl die zijn gekoppeld aan het zuurstofatoom.
Aanvankelijk werd de ethylether gebruikt als een algemene verdoving, geïntroduceerd in 1846 door William Thomas Green Morton. Vanwege de ontvlambaarheid werd het gebruik ervan echter weggegooid en het vervangen door andere minder gevaarlijke anesthetica.
Deze verbinding is ook gebruikt om de bloedcirculatietijd te berekenen, tijdens de evaluatie van de cardiovasculaire status van de patiënt.
Ethyletherstructuur
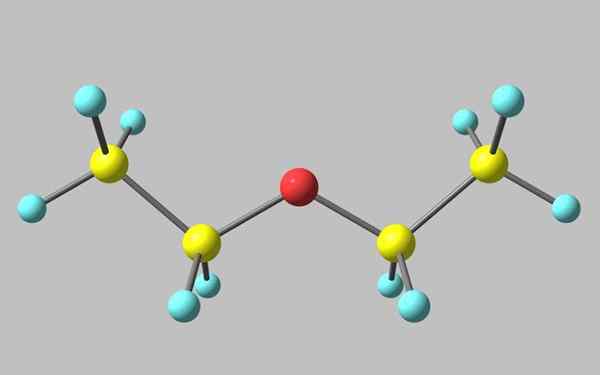 Chemische structuur van ethylether
Chemische structuur van ethylether In het superieure beeld is er een weergave met een model van bollen en staven van de moleculaire structuur van de ethylether.
Zoals te zien is, heeft de rode bol, overeenkomend met het zuurstofatoom, twee ethylgroepen gekoppeld aan beide partijen. Alle links zijn eenvoudig, flexibel en vrije rotatie rond de assen σ.
Deze rotaties zijn afkomstig van stereoisomeren die bekend staan als conformers, wat meer dan isomeren alternatieve ruimtelijke toestanden zijn. De beeldstructuur komt exact overeen met de anti -conformer, waarin alle atoomgroepen gespreid zijn (van elkaar gescheiden).
De andere confruero is overschaduwd, en hoewel het niet het beschikbare beeld is, is het voldoende om het te visualiseren met een U -vorming. Aan de bovenste uiteinden van de U zouden de methylgroepen zich bevinden, -ch3, die sterische afstotingen zou ervaren (ze zouden in de ruimte botsen).
Kan u van dienst zijn: Faraday ConstantDaarom kan worden verwacht dat Cho's molecuul3Ch2Och2Ch3 neem meestal anti -vorming aan.
Fysische en chemische eigenschappen van de ethylether
Andere namen
- Diethyl ether
- Etoxytano
- Ethyloxide
Moleculaire formule
C4H10O o (c2H5))2OF.
Molecuulgewicht
74.14 g/mol.
Fysiek uiterlijk
Kleurloze vloeistof.
Geur
Zoet en kruidig.
Smaak
Branden en zoet.
Kookpunt
94.3 ° F (34.6 ° C) bij 760 mm Hg.
Smeltpunt
-177.3 ° F (-116.3 ° C). Stabiele kristallen.
ontstekingspunt
-49 ° F (gesloten container).
Oplosbaarheid in water
6.04 g/100 ml bij 25 ° C.
Oplosbaarheid in andere vloeistoffen
Mengbaar met korte keten alifatisch, benzeen, chloroform, oliether, vetoplosmiddel, veel oliën en geconcentreerd zoutzuur.
Oplosbaar in aceton en zeer oplosbaar in ethanol. Het is ook oplosbaar in benzine, benzeen en oliën.
Dikte
0.714 mg/ml bij 68 ° F (20 ° C).
Stoomdichtheid
2.55 (met betrekking tot lucht genomen met dichtheid 1).
Dampdruk
442 mm Hg bij 68 ° F. 538 mm Hg bij 25 ° C. 58,6 kPa bij 20 ° C.
Stabiliteit
Het wordt langzaam geoxideerd door de werking van lucht, vochtigheid en licht met peroxidenvorming.
De vorming van peroxiden kan optreden in ethercontainers die meer dan zes maanden open zijn en opslag blijven. Peroxiden kunnen wrijving, impact of verwarming veroorzaken.
Het contact met: zink, halogenen, niet -metalen oxihaluros, sterke oxidatiemiddelen, chromylchloride, treemine -oliën, nitraten en metaalchloriden moeten worden vermeden.
Zelfontsteking
356 ° F (180 ° C).
Ontleding
Als hij opwarmt, breekt hij af, die een hectare en irritante rook uitzenden.
Smurrie
0.2448 POISE bij 20 ° C.
Verbranding warmte
8.807 kcal/g.
Het kan u van dienst zijn: Einstenio (s): structuur, eigenschappen, verkrijgen, gebruikVerdampingswarmte
89.8 limoen/g A 30 ° C.
Oppervlaktespanning
17.06 Dynas/cm bij 20 ° C.
Ionisatiepotentieel
9.53 eV.
Geurdrempel
0.83 ppm (zuiverheid wordt niet gegeven).
Brekingsindex
1.355 tot 15 ° C.
Het verkrijgen van de ethylether
Ethylether uit ethylalcohol kan worden verkregen, in aanwezigheid van zwavelzuur als katalysator. Zwavelzuur in een waterig medium dissocieert het produceren van het hydroniumion, h3OF+.
In het tegenovergestelde proces, dat wil zeggen de hydratatie van ethyleen in de stoomfase, kan ethylether vormen als een onderpandproduct naast ethylalcohol. In feite produceert deze synthetische route het grootste deel van deze organische verbinding.
Toxiciteit van ethylether
Het kan huid- en oogirritaties produceren. Huidcontact kan zijn resectie en kraken produceren. De ether dringt meestal niet door in de huid, omdat deze snel wordt verdampt.
De irritatie van de ogen veroorzaakt door de ether is meestal mild, en in het geval van ernstige irritatie is de schade over het algemeen omkeerbaar.
De inname ervan produceert verdovende effecten en maagirritatie. Ernstige inname kan nierschade veroorzaken.
Ether -inademing kan neus- en keelirritatie veroorzaken. In het geval van een etherinademing kan het worden geproduceerd: slaperigheid, opwinding, duizeligheid, braken, onregelmatige ademhaling en speekselstijging.
Hoge blootstelling kan verlies van kennis en zelfs de dood veroorzaken.
De OSHA stelt gemiddeld een limiet voor de blootstelling aan arbeid van 800 ppm vast, tijdens een verschuiving van 8 uur.
Oogirritatieniveaus: 100 ppm (mensen). Oogirritatieniveaus: 1200 mg/m3 (400 ppm).
Gebruik/toepassingen van de ethylether
Organisch oplosmiddel
Het is een organisch oplosmiddel dat wordt gebruikt om broom, jodium en andere halogenen op te lossen. De meeste lipiden (vetten), harsen, zuivere rubbers, sommige alkaloïden, rubbers, parfums, celluloseacetaat, cellulose -nitraat, koolwaterstoffen en kleurstoffen.
Het kan u van dienst zijn: geen metalen: geschiedenis, eigenschappen, groepen, gebruikBovendien wordt het gebruikt bij de extractie van de actieve ingrediënten van dier- en plantenweefsels, omdat het minder dichtheid heeft dan het water en erop drijft, waardoor de gewenste stoffen in de ether worden opgelost.
Narcose
Het wordt sinds 1840 als algemene verdoving gebruikt, ter vervanging van chloroform voor een therapeutisch voordeel. Het is echter een brandbare stof en vindt daarom ernstige moeilijkheden bij het gebruik ervan binnen klinische gebieden.
Bovendien produceert het bij patiënten enkele ongewenste postoperatieve bijwerkingen, zoals misselijkheid en braken.
Om deze redenen is het gebruik van de ether weggegooid als een algemene verdoving, waarbij het wordt vervangen door andere anesthetica zoals Halotano.
Ether Spirit
Ether gemengde ethanol.
Bloedcirculatie -evaluatie
De ether is gebruikt om de bloedcirculatie tussen één arm en de longen te evalueren. De ether wordt in een arm geïnjecteerd en brengt het bloed naar het rechter atrium, vervolgens naar de rechter ventrikel en van daar naar de longen.
De tijd die verloopt van de injectie van de ether, tot het vangen van de geur van de ether in de uitgeademde lucht, is ongeveer 4 tot 6 s.
Onderwijslaboratoria
De ether wordt in veel experimenten gebruikt in het onderwijzen van laboratoria. Bijvoorbeeld in de demonstratie van Mendel's wetten van genetica.
De ether wordt gebruikt om het geslacht te verdoven Drosophila en laat de nodige kruisen tussen hen toe, om de wetten van genetica te benadrukken.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. Organische chemie. Amines. Wiley Plus.
- Ethher ether. Hersteld uit Britannica.com

