Botsingstheorie -systemen, energie, voorbeelden
- 3869
- 197
- Lonnie Rohan
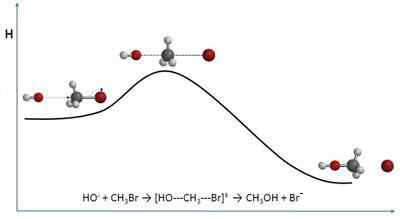
De botsingstheorie Leg de snelheden van chemische reacties uit vanuit een louter moleculair perspectief. Het is daarom dicht bij de chemische kinetiek. In plaats van snelheden te benaderen in termen van concentraties, doet dit dit op basis van botsfrequenties.
Als u het over botsingen hebt, kan het beeld van sommige biljartballen in me op de tafel brengen. Moleculen, hoewel deze theorie echter ervan uitgaat dat zijn vormen bolvormig zijn, gedragen zich echter niet op dezelfde manier. Moleculaire botsingen verschillen op verschillende manieren, zowel ruimtelijk als energie.

Deze theorie, hoewel het wiskundig een beetje complex kan zijn en aanzienlijke variaties vertoont met betrekking tot experimentele resultaten, biedt een beeld van zichtbare interpretaties en zonder abstracte aspecten.
Hoewel het wordt toegepast voor gasvormige systemen of zeer verdunde oplossingen, kunnen de principes zich uitstrekken tot elke reactie en fysiek medium.
[TOC]
Omstandigheden voor het optreden van reacties
Volgens de theorie van de botsingen zijn er drie voorwaarden voor reacties:
- Chemische soorten (ionen, moleculen, radicalen, enz.) Ze moeten efficiënt botsen.
- Ze moeten voldoende energie dragen voor de afbraak van hun links.
- Bovendien moet de impactoriëntatie heel specifiek zijn.
Moleculaire botsingen
 Net als bij het bowlen vinden er alleen reacties plaats wanneer efficiënte botsingen optreden in termen van energie en begeleiding
Net als bij het bowlen vinden er alleen reacties plaats wanneer efficiënte botsingen optreden in termen van energie en begeleiding Moleculaire botsingen delen iets gemeen met macroscopisch: ze komen voornamelijk voor tussen twee soorten of lichamen. Twee biljartballen botsen met elkaar, evenals een voetbalbal tegen een muur, of twee projectielen in het midden van de lucht. Dat wil zeggen, botsingen met betrekking tot de chemie en de reacties ervan zijn meestal bimoleculair type.
Kan u van dienst zijn: ionisatie in natuurkunde en chemie: concept, proces en voorbeeldenDe moleculen zijn niet stil, maar ze bewegen en roteren door de ruimte die hen omringen. Door dit te doen, wordt aangenomen dat ze een soort cirkel tekenen die dwarsdoorsnede wordt genoemd, waarop de kans is dat een andere Colison -molecuul. Evenzo is de theorie van mening dat moleculen bolvormig zijn om wiskundige modellen te vereenvoudigen.
Twee moleculen, hypothetisch bolvormig, kunnen zonder enig probleem botsen, zelfs als er geen chemische reactie is. Maar het gebeurt niet op dezelfde manier als het gaat om drie, vier of meer moleculen.
Hoe meer soorten ze moeten botsen om een product te ontstaan, hoe onwaarschijnlijker het fenomeen wordt. Dit wordt visueel uitgelegd om te proberen dat drie ballen of projectielen tegelijkertijd samen botsen. Daarom zijn bimoleculaire botsingen veruit de meest voorkomende.
Systemen
Botsingstheorie is alleen geldig voor softwaresystemen of fasen. Dit komt omdat gassen gedrag vertonen dat goed kan worden beschreven door hun kinetiek.
Voor vloeibare fasen of zeer verdunde oplossingen zijn reactieve soorten gewikkeld in een kooi van een oplosmiddelmoleculen, waarmee ze ook botsen. Dit wijzigt het panorama, omdat de reacties niet alleen afhankelijk zijn van de frequenties van de botsingen, maar ook van de diffusie van de reactantmoleculen door het medium.
Botsingsenergieën
De moleculen kunnen langzaam of zeer snel botsen. Dit hangt af van hoe groot zijn energie is, die op zijn beurt aanzienlijk varieert met de temperatuur. Hoe sterker de botsing, de kans dat er een chemische reactie is, zal toenemen, omdat deze energie de nodige links kan verbreken om nieuwe te vormen.
Kan u van dienst zijn: monomerenDeze energie staat bekend als activering, enNAAR, En het is kenmerkend voor elke chemische reactie. Wanneer de temperatuur stijgt, is het gemiddelde van de moleculen in staat om E te matchen of te overtreffenNAAR, Dus het aantal effectieve botsingen en daarom de gevormde producten, stijgen.
In aanwezigheid van een katalysator enNAAR neemt af, omdat het oppervlakken en elektronische middelen biedt die botsingen voordelen hebben. Het resultaat: de reactiesnelheid neemt toe, zonder de temperatuur te verhogen of andere reagentia toe te voegen.
Sterische factor
Chemische soorten botsen effectief om te reageren en voorspelt deze theorie wat de snelheid van hun reacties zal zijn. Experimenten hebben echter aangetoond dat hoe complexer de structuren van de reagentia zijn, hoe groter de afwijkingen of verschillen tussen de theoretische en experimentele snelheden.
Dit komt omdat de moleculen verre van bolvormig zijn, maar ruimtelijk allerlei geometrieën hebben. Dit is waar de sterische factor binnenkomt, ρ, waarmee het de reactiesnelheden wil corrigeren, zodat de voorspellingen van de theorie met de experimentele resultaten beter zijn.
Voorbeelden van reacties
Bimoleculaire reactie
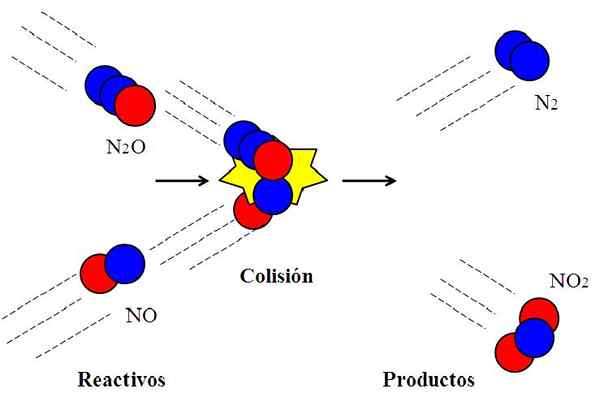 Effectieve botsing tussen stikstofoxiden. Bron: Gabriel Bolívar.
Effectieve botsing tussen stikstofoxiden. Bron: Gabriel Bolívar. De volgende reactie:
N2O + nee → n2 + NEE2
Het wordt vaak gebruikt om uit te leggen wat effectieve oriëntatie betekent in moleculaire botsingen.
Het molecuul n2Of, dyitrogenoxide, het zal niet reageren met het nee, stikstofoxide, tenzij tijdens de botsing het zuurstofatoom (rode cirkel) van de n2Of schok rechtstreeks met het stikstofatoom (blauwe cirkel) van de NO. Alleen op deze manier zullen de producten N ontstaan2 en niet2; Anders n moleculen2O en ze zullen niet stuiteren zonder te reageren.
Kan u van dienst zijn: Gaseous State: kenmerken, algemene wetgeving, voorbeeldenDit is een voorbeeld van een bimoleculaire botsing voor een elementaire bimoleculaire reactie. Zelfs wanneer reagentia voldoende energie hebben om de links te verbreken, als de oriëntatie niet geschikt is, is er geen chemische reactie.
Onimoleculaire reactie
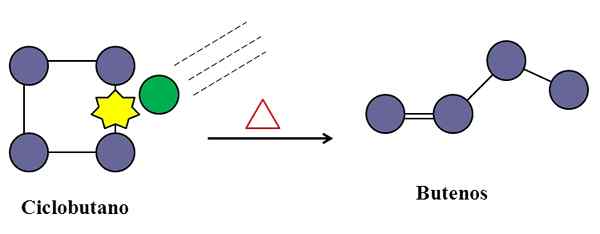 Botsingen zijn ook onmisbaar voor isomerisatie van cyclobutaan. Bron: Gabriel Bolívar.
Botsingen zijn ook onmisbaar voor isomerisatie van cyclobutaan. Bron: Gabriel Bolívar. In een unimoleculaire elementaire reactie kunnen moleculaire botsingen ook ingrijpen, zelfs als het alleen een soort is die lijdt aan de transformatie of afbraak van zijn links.
Overweeg bijvoorbeeld de isomerisatie van het cyclobutaan om aanleiding te geven tot een mengsel van butanen. Wanneer de temperatuur stijgt, zullen cyclobutaanmoleculen trillen bij hogere frequenties en botsen met grotere kracht. De producten laten echter zien dat twee cyclobutaanmoleculen niet op elkaar reageren, omdat ze anders een verbinding zouden produceren met acht koolstofatomen.
In het midden kunnen er onzuiverheden zijn (groene cirkel), die ook botsen met het cyclobutaan, specifiek op een van zijn C-C-links. Dit kunnen edelgassen zijn, of niet zeer reactieve moleculen zoals stikstof.
Er zal een tijd komen dat onzuiverheid zal botsen met voldoende energie om een van de C-C-banden van de cyclobutaan te verbreken. En dan zal het molecuul proberen een buuteen te herschikken en te ontstaan, herkenbaar voor zijn dubbele binding en zijn lineaire kettingstructuur.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Glasstone. (1970). Fysicochemie verdrag. Aguile s. NAAR. van edities, Juan Bravo, 38, Madrid (Spanje).
- Walter J. Moore. (1962). Fysische chemie. (Vierde druk). Longmans.
- Wikipedia. (2020). Botsingstheorie. Opgehaald uit: in.Wikipedia.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Botsingstheorie. Britannica Encyclopaedia. Hersteld van: Britannica.com
- Clark Jim. (2018). De colisietheorie van reactiesnelheden. Hersteld van: chemguide.co.Uk
- Lawson P. & Lagere s. (18 mei 2020). De colisietheorie. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- « Didactische tekstkenmerken, structuur, typen en voorbeelden
- Insulair Amerika of Antilles -landen en kenmerken »

