Oppervlaktespanning veroorzaakt, voorbeelden, toepassingen en experimenten

- 3405
- 776
- Glen Armstrong
De oppervlaktespanning Het is een fysieke eigenschap die alle aanwezige vloeistoffen aanwezig is en wordt gekenmerkt door de weerstand dat hun oppervlakken zich verzetten tegen elke toename van hun gebied. Dit is hetzelfde als zeggen dat dit oppervlak naar het minst mogelijke gebied zal zoeken. Dit fenomeen heeft verschillende chemische concepten, zoals cohesie, hechting en intermoleculaire krachten, met elkaar.
De oppervlaktespanning is verantwoordelijk voor de vorming van de krommingen van het oppervlak van de vloeistoffen in buisvormige containers (afgestudeerde cilinders, kolommen, testbuizen, enz.)). Deze kunnen concaaf zijn (vallei gebogen) of convexe (gebogen koepel). Veel fysische fenomenen kunnen worden verklaard, gezien de veranderingen die worden geleden door de oppervlaktespanning van een vloeistof.
 De bolvormige vormen die worden aangenomen door waterdruppels op de bladeren zijn deels te wijten aan hun oppervlaktespanning. Bron: Foto gemaakt door Flickr -gebruiker Tanakawho [CC door (https: // creativeCommons.Org/licenties/door/2.0)]
De bolvormige vormen die worden aangenomen door waterdruppels op de bladeren zijn deels te wijten aan hun oppervlaktespanning. Bron: Foto gemaakt door Flickr -gebruiker Tanakawho [CC door (https: // creativeCommons.Org/licenties/door/2.0)] Een van deze fenomenen is de trend dat de moleculen vloeistoffen moeten agglomereren in de vorm van druppels, wanneer ze rusten op oppervlakken die ze afstoten. De waterdruppels die we boven de bladeren zien, kunnen het bijvoorbeeld niet nat maken vanwege de heuvel, hydrofoob oppervlak.
Er komt echter een tijd dat de zwaartekracht zijn rol uitoefent en de druppel wordt gemorst als een waterkolom. Soortgelijk fenomeen treedt op in de bolvormige druppels van Mercurius wanneer een thermometer wordt gemorst.
Aan de andere kant is oppervlaktewaterspanning de belangrijkste van allemaal, omdat het de status van microscopische lichamen in waterige media, zoals cellen en hun lipidenmembranen, bijdraagt en organiseert. Bovendien is deze spanning verantwoordelijk voor water om langzaam te verdampen, en enkele dichtste lichamen die op het oppervlak kunnen drijven.
[TOC]
Oorzaken van oppervlaktespanning
De verklaring van het oppervlaktespanningsfenomeen bevindt zich op moleculair niveau. De moleculen van een vloeistof interageren met elkaar, zodat ze samenhangend zijn in hun grillige bewegingen. Een molecuul interageert met zijn buren naast de deur en degenen die er boven of onder zijn.
Dit gebeurt echter niet hetzelfde met de moleculen van het oppervlak van de vloeistof, die in contact zijn met de lucht (of enig ander gas), of met een vaste stof. De oppervlaktemoleculen kunnen niet samenhangen met die van de externe omgeving.
Als gevolg hiervan ervaren ze geen enkele kracht die hen aantrekt; Alleen naar beneden, van zijn buren van het vloeibare medium. Om deze onbalans tegen te gaan, worden de oppervlaktemoleculen "geperst", omdat ze alleen dan erin slagen de kracht te overwinnen die hen naar beneden duwt.
Kan u van dienst zijn: natriumsilicaat (NA2SIO3): structuur, eigenschappen, gebruik, risico'sEr wordt vervolgens een oppervlak gemaakt waar de moleculen in een meer gespannen verwijdering zijn. Als een deeltje in de vloeistof wil doordringen, moet het eerst deze moleculaire barrière oversteken die evenredig is met de oppervlaktespanning van genoemde vloeistof. Hetzelfde geldt voor een deeltje dat vanuit de diepten van de vloeistof naar de externe omgeving wil ontsnappen.
Daarom gedraagt het oppervlak zich alsof het een elastische film is die weerstand tegen misvorming toont.
Eenheden
De oppervlaktespanning wordt meestal weergegeven met het γ -symbool en wordt tot expressie gebracht in N/M -eenheden, kracht op lengte. Meestal is uw eenheid echter dyn/cm. De een kan de andere worden door de volgende conversiefactor:
1 dyn/cm = 0,001 N/m
Oppervlaktewaterspanning
Water is het westen en het meest verrassend van alle vloeistoffen. De oppervlaktespanning, evenals verschillende van zijn eigenschappen, hebben een ongewoon hoge waarde: 72 dyn/cm bij kamertemperatuur. Deze waarde kan toenemen tot 75,64 dyn/cm, bij een temperatuur van 0 ºC; of afnemen tot 58,85 ºC, bij een temperatuur van 100 ºC.
Deze observaties zijn logisch als wordt overwogen dat de moleculaire barrière nog meer gespannen is bij temperaturen dicht bij het vriespunt, of iets meer "los te maken" rond het kookpunt.
Water heeft grote oppervlaktespanning volgens zijn waterstofbruggen. Als deze berucht zijn in de vloeistof, zijn ze nog meer aan de oppervlakte. Watermoleculen zijn sterk verweven door dipool-dipolo-interacties van type H te vormen2OH OH.
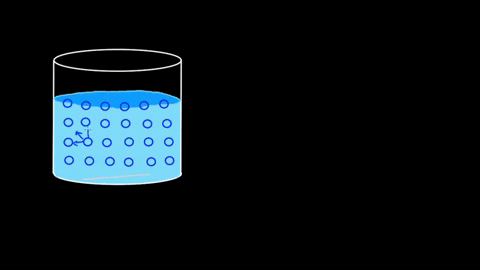 Watermoleculen trekken elkaar aan; Ze worden gekoppeld door waterstofbruggen
Watermoleculen trekken elkaar aan; Ze worden gekoppeld door waterstofbruggen De efficiëntie van zijn interacties is zodanig dat de waterige moleculaire barrière zelfs sommige lichamen kan onderhouden voordat ze zinken. In de secties van toepassingen en experimenten wordt dit punt hervat.
Andere voorbeelden
Alle vloeistoffen hebben oppervlaktespanningen, in mindere of grotere mate dan die van water, of als het pure stoffen of oplossingen zijn. Hoe sterk en gespannen zijn de moleculaire barrières van hun oppervlakkige, het zal direct afhangen van zijn intermoleculaire interacties, naast structurele en energiefactoren.
Gecondenseerde gassen
Gasemoleculen in vloeibare toestand hebben bijvoorbeeld alleen met elkaar in wisselwerking via dispersieve krachten in Londen. Dit komt overeen met het feit dat hun oppervlakkige spanningen lage waarden hebben:
-Vloeibaar helium, 0,37 dyn/cm a -273 ºC
Het kan u van dienst zijn: ammoniumchloride (NH4CL)-Vloeibare stikstof, 8,85 dyn/cm a -196 ºC
-Vloeibare zuurstof, 13,2 dyn/cm a -182 ºC
De oppervlaktespanning van vloeibare zuurstof is groter dan die van het helium omdat de moleculen een grotere massa hebben.
Apolaire vloeistoffen
Van apolaire en organische vloeistoffen wordt van hen verwacht dat ze hogere oppervlaktespanningen hebben dan die van deze gecondenseerde gassen. Onder sommige van hen hebben we het volgende:
-Diëtileter, 17 dyn/cm bij 20 ºC
-N-Hexano, 18,40 dyn/cm bij 20 ºC
-N-Octaan, 21,80 dyn/cm bij 20 ºC
-Tolueen, 27,73 dyn/cm bij 25 ºC
Een vergelijkbare trend wordt waargenomen voor deze vloeistoffen: de oppervlaktespanning wordt verhoogd naarmate de moleculaire massa toeneemt. Echter, de N-Octaan moet volgens dit de grootste oppervlaktespanning hebben en niet de tolueen. Hier komen de moleculaire structuren en geometrieën in het spel.
Tolueen-, plan- en anillares -moleculen hebben effectievere interacties dan die van de N-octaan. Daarom is het oppervlak van de tolueen "gespannen" dan het oppervlak van de N-octaan.
Polaire vloeistoffen
Sterker dipool-dipol zijn. Maar het is niet altijd het geval. Onder enkele voorbeelden hebben we:
-Azijnzuur, 27,60 dyn/cm bij 20 ºC
-Aceton, 23,70 dyn/cm bij 20 ºC
-Bloed, 55,89 dyn/cm bij 22 ° C
-Ethanol, 22.27 dyn/cm bij 20 ºC
-Glycerol, 63 dyn/cm bij 20 ºC
-Gesmolten natriumchloride, 163 dyn/cm bij 650 ºC
-NaCl 6 M -oplossing, 82,55 dyn/cm bij 20 ºC
Verwacht wordt dat gesmolten natriumchloride een enorme oppervlaktespanning heeft: het is een viskeuze en ionische vloeistof.
Aan de andere kant is kwik een van de vloeistoffen met de hoogste oppervlaktespanning: 487 dyn/cm. Daarin bestaat het oppervlak uit sterk samenhangende kwikatomen, veel meer dan de watermoleculen kunnen zijn.
Toepassingen
 Sommige insecten gebruiken de oppervlaktespanning van het water om erop te lopen. Bron: Pixabay.
Sommige insecten gebruiken de oppervlaktespanning van het water om erop te lopen. Bron: Pixabay. Oppervlakkige spanning alleen mist toepassingen. Dit betekent echter niet dat het niet betrokken is bij verschillende dagelijkse fenomenen, dat als dat niet het geval was, ze niet zouden gebeuren.
Muggen en andere insecten kunnen bijvoorbeeld door water lopen. Dit komt omdat hun hydrofobe benen het water afstoten, tegelijkertijd dat hun kleine massa hen toestaat.

Oppervlakkige spanning voldoet ook een rol bij vloeistof bevochtiging. Hoe groter zijn oppervlakkige spanning, hoe minder zijn neiging om door de poriën of kuikens van een materiaal te lekken. Daarnaast zijn het weinig nuttige vloeistoffen om oppervlakken schoon te maken.
Kan u van dienst zijn: neutralisatiereactieWasmiddelen
Het is hier waar de wasmiddelen werken, waardoor de oppervlaktespanning van het water wordt verminderd en het helpt om grotere oppervlakken te bedekken; Terwijl u uw degreaser -actie verbetert. Door zijn oppervlakkige spanning te verminderen, herbergt het luchtmoleculen, waarmee bubbels vormen.
Emulsies
Aan de andere kant zijn lage hogere spanningen gekoppeld aan de stabilisatie van emulsies, zeer belangrijk bij de formulering van verschillende productenbereik.
Eenvoudige experimenten
 Metalen clip zwevend door oppervlaktewaterspanning. Bron: Alvesgaspar [CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Metalen clip zwevend door oppervlaktewaterspanning. Bron: Alvesgaspar [CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)] Ten slotte worden enkele experimenten die in elke binnenlandse ruimte kunnen worden gedaan, aangehaald.
Clip Experiment
In een glas met koud water wordt een metalen clip op het oppervlak geplaatst. Zoals te zien in de bovenste afbeelding, blijft de clip overeind dankzij de oppervlaktespanning van het water. Maar als een beetje lava loza aan het glas wordt toegevoegd, zal de oppervlaktespanning dramatisch afnemen en zal de clip plotseling zinken.

Papieren boot
Als we een papieren schip of een houten palet hebben, en als u het kleine of het wasmiddel wast, wordt het in het hoofd van een wattenstaafje toegevoegd, dan zal er een interessant fenomeen plaatsvinden: er zal een afstoting zijn die hen naar de randen zal verspreiden van het glas. Het papierschip en het houtpalet zullen weggaan van het wattenstaafje besmeurd met wasmiddel.

Een ander soortgelijk en meer grafisch experiment is om dezelfde bewerking te herhalen, maar in een emmer water gespoten met zwarte peper. De zwarte pepersdeeltjes zullen weggaan en het oppervlak gaat van peper naar kristallijn, met de randen aan de randen.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Oppervlaktespanning. Opgehaald uit: in.Wikipedia.borg
- USGS. (S.F.)). Oppervlaktespanning en water. Opgehaald uit: USGS.Gov
- Jones, Andrew Zimmerman. (12 februari 2020). Oppervlaktespanning - Definitie en experimenten. Hersteld van: Thoughtco.com
- Susanna Lauren. (15 november 2017). Waarom is oppervlaktespanning belangrijk? Biolin wetenschappelijk. Hersteld van: blog.Biolinscientific.com
- Rookie ouderschap wetenschap. (7 november 2019). Wat is oppervlaktespanning | Cool Science Experiment. Hersteld van: rookieParenting.com
- Jessica Mock. (2020). Oppervlaktespanningsexperiment. Studie. Hersteld van: studie.com
- Het kind zou dit moeten zien. (2020). Zeven oppervlaktespanningsexperimenten - natuurkunde meisje. Hersteld van: thekidshoulseThis.com
- « De meest opvallende 13 uitvindingen van Egypte
- Cerebrale atrofie -kenmerken, symptomen en oorzaken »

