Aromatisch elektrofiel substitutiemechanisme en voorbeelden

- 4756
- 560
- Pete Heaney V
De Aromatische elektrofiele vervanging (Sear) Het is een organische reactie waarbij een slechte soort in elektronen, dat wil zeggen een elektrofie, een van de hydrogenen van een aromatische ring vervangt. Deze reactie is tegen de toevoegingen die alkenen hebben geleden, wat het effect van aromaticiteit op de reactiviteiten van benzeen en zijn derivaten aantoont.
De elektrofiel wordt vele malen gegenereerd tijdens hetzelfde moleculaire mechanisme, product van het mengsel van de reagentia en een katalysator, die bestaat uit een zuur van Lewis, bijvoorbeeld allemaal3 of fecl3. Deze katalysatoren verhogen de aviditeit van de elektrofiel door de elektronen van de aromatische ring, waardoor de reactie wordt versneld.
 In de aromatische elektrofiele substitutie is het de benzeenring die de elektrofiel aanvalt. Bron: Gabriel Bolívar via Molview.
In de aromatische elektrofiele substitutie is het de benzeenring die de elektrofiel aanvalt. Bron: Gabriel Bolívar via Molview. In het superieure beeld hebben we een eenvoudige weergave van de elektrofiele aanval van benzeen naar de elektrofiel en+. Merk op dat de aanval afkomstig is van de elektronen van een van de dubbele bindingen; dat wil zeggen, het zijn de elektronen van het geconjugeerde π -systeem die de schroeier beginnen.
Deze reactie maakt het mogelijk voor benzeen en andere aromatische verbindingen om substituenten zoals OH -groepen te verwerven, niet2, SW3H, CL, BR, R, Cor, Coch3, onder andere. Het fenol wordt bijvoorbeeld gesynthetiseerd via Sear, beginnend bij benzeen en andere derivaten.
[TOC]
Aromatisch elektrofiel substitutiemechanisme
Stap 1: Elektrofylische aanval
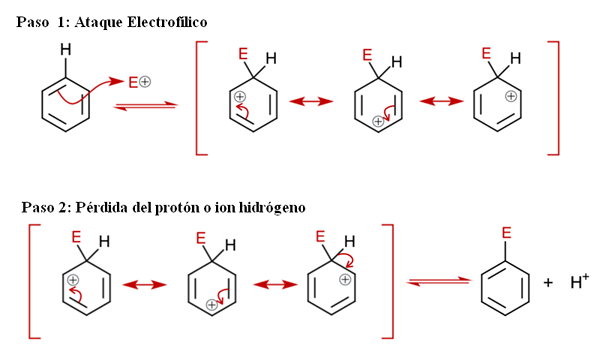 Algemeen mechanisme voor Sear. Bron: Soonlorpai via Wikipedia.
Algemeen mechanisme voor Sear. Bron: Soonlorpai via Wikipedia. In het superieure beeld wordt het mechanisme van aromatische elektrofiele substitutie in meer detail weergegeven. Elk van de drie dubbele bindingen van benzeen valt de elektrofiel aan en+, Om een intermediaire soort te vormen die bekend staat als Ion Arenio (gedelokaliseerde cyclohexadien), opgesloten in rode beugels.
Kan u van dienst zijn: chemische neerslagMerk op dat de positieve belasting van E+ Ga nu naar het interieur van de ring. Maar niet alleen dat: het verplaatst tussen drie koolstofatomen in ortho (aangrenzende) posities en voor (tegengesteld) aan koolstof gekoppeld aan E (C-E). Deze tussenpersoon bestaat precies dankzij de stabiliteit die door zijn resonantiestructuren wordt verleend.
Stap 2: Verlies van het proton- of waterstofion
Het arenio -ion moet echter snel zijn positieve belasting neutraliseren door een waterstofproton of ion te verliezen. Dit is waar vervanging culmineert. De elektrofiel e+ vervangt daarom een van de benzeenhydrogenen, waardoor dit achterblijft als ion h+ buiten de ring, zodat positieve kosten worden bewaard.
Als het zorgvuldig wordt waargenomen, zijn alle stappen in evenwicht, dus de vervanging is omkeerbaar. Dat wil zeggen, als de concentraties van h worden verhoogd+, dan zal een waterstof E vervangen en we zullen de reagentia opnieuw verkrijgen.
Voorbeelden van aromatische elektrofiele substitutie
Benzeen
De benzeen sear is de eenvoudigste van allemaal, al hierboven weergegeven. Elk van de hydrogenen kan worden vervangen door E+, Omdat ze allemaal chemisch equivalent zijn.
Er zijn geen verschillen van elkaar. Daarom is de kans dat vervanging plaatsvindt in een van de zes koolstofatomen hetzelfde. Alles verandert echter wanneer er andere substituenten aanwezig zijn in de benzenische ring, zoals we hieronder zullen zien.
Fenol
Ortho, voor en doelaanvallen
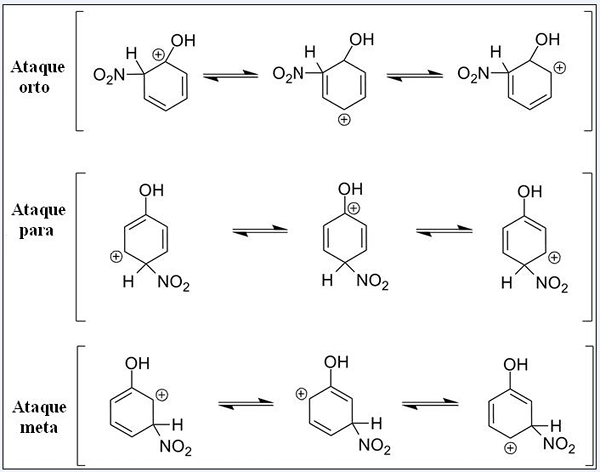 Resonantiestructuren voor fenol in zijn aromatische elektrofiele substitutiereactie. Bron: Pete Davis, Public Domain, via Wikimedia Commons
Resonantiestructuren voor fenol in zijn aromatische elektrofiele substitutiereactie. Bron: Pete Davis, Public Domain, via Wikimedia Commons Overweeg nu de Sear voor de Fenol. Deze keer is de elektrofie het nitronische kation, niet2+, die bij het linken naar de benzeenring wordt omgezet in de nitro -groep, -no2.
Kan u van dienst zijn: nitraten: eigenschappen, structuur, nomenclatuur, trainingNu een OH -groep aanwezig is, zijn de andere hydrogenen ophouden chemisch equivalent te zijn; Sommige zijn gevoeliger voor vervangen dan andere. En bovendien heeft OH op dit moment een directe invloed uit.
We hebben drie substituties in verschillende posities gerelateerd aan OH: ortho -aanvallen, voor en doel. Merk op dat we in alle drie het zandige kation en de resonantiestructuren hebben. In de ortho -aanvallen en voor, bevindt de positieve belasting in de benzeenring zich direct in de koolstof gekoppeld aan OH; Terwijl dit in de doelaanval is, gebeurt dit niet.
Oh als een orthoproep en voor regisseur
Oh presenteert het vermogen om elektronen aan de ring te geven via resonantie en inductie. In beide kan het helpen de positieve belasting in de koolstof waarmee deze is gekoppeld, de structuur stabiliseren, de structuur stabiliseren. Integendeel, wanneer de doelaanval optreedt, kan OH de positieve belasting niet op dezelfde manier stabiliseren, waarbij de structuur onstabieler is.
Daarom zijn ortho -aanvallen en voor meer energie begunstigd. Er wordt dan gezegd dat OH een ortho-voor directeur groep is, die ook de benzene ring naar Sear kan activeren. Dat wil zeggen, het fenol reageert veel sneller dan benzeen, wat wordt aangetoond door reactiesnelheden te meten.
Arilamines
 Resonantiestructuren voor aniline in zijn aromatische elektrofiele substitutiereactie. Bron: V8rik bij Engelse Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Resonantiestructuren voor aniline in zijn aromatische elektrofiele substitutiereactie. Bron: V8rik bij Engelse Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Het geval van de arilamines, zoals die van aniline (superieur beeld), is vergelijkbaar met die van fenol. Merk op dat in zijn mechanisme deze keer de stabilisatie van de positieve belasting op het stikstofatoom (h2N+=), het helpen van de substitutie om gericht te worden op orthoposities en voor, zoals bij de OH.
Het kan u van dienst zijn: zure-bass-theorieën: Arrhenius, Bronsted-Lowry, LewisNu is aniline reactiever dan fenol tegen elektrofiele substitutie. Omdat? Omdat het stikstofatoom minder elektronegatief is dan dat van zuurstof, daarom geeft het zijn paar vrije elektronen gemakkelijker aan de aromatische ring. Zuurstof, omdat het meer elektronegatief is, levert een van zijn elektronenparen met minder "aviditeit" op.
Ook is de atomaire stikstofstraal dichter bij die van koolstof dichter bij die van koolstof. Dit heeft een impact op het feit dat resonantie plaatsvindt, vooral tussen atomen met vergelijkbare radio's of maten. Daarom is de resonantie tussen koolstof en stikstof iets stabieler en efficiënter dan die tussen koolstof en zuurstof.
Chloorbenzeen
In chloorbenzeen daarentegen vertraagt het atoom van CL de substitutie vanwege de elektronegativiteit. En hoewel het ook in staat is om elektronen te doneren vanwege resonantie aan de ring, is de atoomradius aanzienlijk groter dan die van koolstof, waardoor de elektronische bijdrage wordt afgenomen.
Als reactie reageert chloorbenzeen 50 keer langzamer dan benzeen, omdat de ring is gedeactiveerd vanwege chloor. En ook, het aantrekken van elektronen naar zichzelf, chloor is een doelgroep, dus substituties zullen voornamelijk in die positie optreden.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Aromatische verbinding. Opgehaald uit: in.Wikipedia.borg
- Ed Vitz et al. (8 september 2020). Aromatische koolwaterstoffen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Wyman Elizabeth. (2020). Aromatische koolwaterstoffen: definitie, voorbeeld en gebruik. Studie. Hersteld van: studie.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). De chemische complexiteit van automotive benzine. Wetenschap, engineering en applicaties,2(2), 51-79. Doi: doi.org/10.22206/cyap.20199999999999999999999999999999999999999111 2019 2019 20199999 E moetene9999191999998311133113331322111152222222111231311111111111122111111111121111111111111111111111111111 -11111111111a's11111a's1a's1a's1a's1a's1a's D1a's Dam dat ’TO.V2I2.PP51-79
- « Thermische energiekarakteristieken, verkrijgen, overbrengen
- Aluminiumoxidestructuur, eigenschappen, gebruik, nomenclatuur »

