Levering diverse kenmerken, structuur, functies
- 1386
- 420
- Hugo Crooks
De Dysmutas superoxide ((Zode) of oxidorteerd superoxide, Ze vormen een familie van alomtegenwoordige enzymen in de natuur, waarvan de belangrijkste functie bestaat uit de verdediging van aerobe organismen tegen zuurstofvrije radicalen, vooral superoxideanionische radicalen.
De reactie die deze enzymen katalyseren vindt vrijwel plaats in alle cellen die in staat zijn om te ademen (aerobics) en is essentieel voor hun overleving, omdat het radicaal giftig vrij van zuurstof elimineert, zowel in eukaryoten als in lekkaryoten.
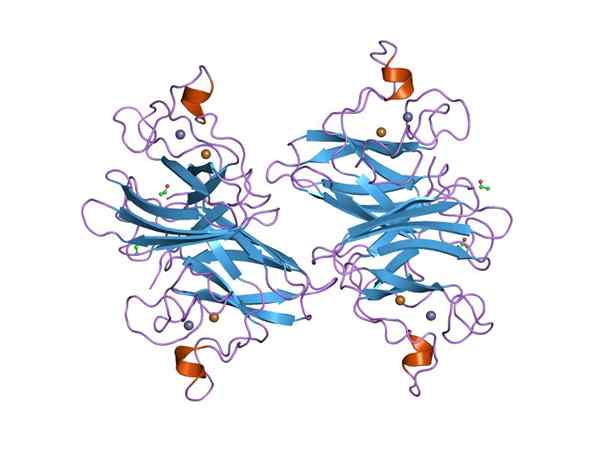
 Grafische weergave van een dymputase-superoxide (SOD) Cu-Zn (Bron: Jawahar Swaminathan en MSD-personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) via Wikimedia Commons)
Grafische weergave van een dymputase-superoxide (SOD) Cu-Zn (Bron: Jawahar Swaminathan en MSD-personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) via Wikimedia Commons) Veel ziekten bij dieren zijn gerelateerd aan de accumulatie van verschillende reactieve zuurstofsoorten, en hetzelfde geldt voor planten, aangezien de omgeving talloze en constante soorten oxidatieve stress oplegt die worden overwonnen dankzij de activiteit van het afwijzen van superoxide.
Deze groep enzymen werd in 1969 ontdekt door McCord en Fridovich en sindsdien zijn er aanzienlijke vooruitgang geboekt met betrekking tot deze enzymen en de reacties die katalyseren in levende wezens.
[TOC]
Kenmerken
Dysmutas superoxide reageren met superxide -radicalen tot echt hoge snelheden, wat zich vertaalt in een zeer effectieve verdedigingslijn voor het verwijderen van deze moleculen.
Bij zoogdieren zijn ten minste drie isovormen beschreven voor respectievelijk overroxidedysmutase bekend als SOD1, SOD2 en SOD3.
Twee van deze isovormen hebben koper- en zinkatomen in hun katalytische centra en verschillen van elkaar in termen van hun locatie: intracellulair (cytosolisch, SOD1 of Cu/Zn-SOD) of met extracellulaire elementen (EC-SOD of SOD3).
De SOD2- of MN-SOD-isovorm, in tegenstelling tot de vorige twee, heeft een mangaanatoom als een cofactor en de locatie lijkt beperkt tot de mitochondriën van de aerobe cellen.
SOD1 -isoenzymen zijn voornamelijk in cytosol, hoewel ze ook zijn gedetecteerd in de nucleaire compartiment en lysosomen. SOD 3 isoenzymen daarentegen zijn beschreven in het bloedplasma van mensen, in lymfe en hersenvloeistoffen.
Kan u van dienst zijn: hoe veranderen levende wezens in de loop van de tijd?Elk van deze isovormen wordt gecodeerd door verschillende genen, maar behorend tot dezelfde familie en de transcriptionele regulatie ervan wordt in wezen geregeld door extra-intracellulaire omstandigheden, die verschillende interne signaalwateruitval veroorzaken.
Andere ontslag -superoxide
Dysmonisch superoxide met katalytische plaatsen met koper- en zink- of mangaanionen ionen zijn niet uniek voor zoogdieren, deze zijn ook aanwezig in andere organismen die planten en bacteriën van verschillende klassen omvatten.
Er is een extra groep dysmutas -superoxide, die niet wordt gevonden in zoogdieren, en die gemakkelijk herkenbaar zijn, omdat ze op hun actieve plaats ijzer hebben in plaats van een van de drie ionen die eerder zijn beschreven voor de andere klassen van dysmatige superoxide.
In EN. coli, Het overroxidedysmi -in dat het ijzer bevat, is een perplastisch enzym dat ook de leiding heeft over de detectie en eliminatie van zuurstofvrije radicalen die zijn gegenereerd tijdens ademhaling. Dit enzym is vergelijkbaar met dat gevonden in de mitochondria van veel eukaryoten.
De planten hebben de drie soorten enzymen: die die koper en zink (Cu/Zn-SOD) bevatten, die mangaan (Mn-SOD) bevatten en die met ijzer (Fe-SOD) in hun actieve centrum en in deze organismen oefenen ze uit analoge functies aan die van niet-vegetale enzymen.
Reactie
Dysmie-superoxide-enzymsubstraten zijn superoxide-anionen, die worden weergegeven als O2- en die intermediaire verbindingen zijn in het zuurstofreductieproces.
De reactie die ze katalyseren, kan worden overwogen in algemene lijnen zoals de transformatie (betwisting) van vrije radicalen voor de vorming van moleculaire zuurstof en waterstofperoxide, die respectievelijk aan de omgeving of werknemers worden vrijgegeven als een substraat van andere enzymen,.
Kan u van dienst zijn: glucans: structuur, kenmerken en functiesWaterstofperoxide kan vervolgens worden geëlimineerd uit cellen dankzij de werking van een van de maar peroxidase- en catalase -glutathionenzymen, die ook belangrijke functies in celbescherming uitoefenen.
Structuur
Dysmutas superoxide -isoenzymen bij mensen kunnen van elkaar verschillen in termen van bepaalde structurele aspecten. Het SOD1 -isoenzym is bijvoorbeeld 32 kDa molecuulgewicht, terwijl SOD2 en SOD3 homotetrices zijn van respectievelijk 95 en 135 kDa molecuulgewicht.
De andere groep dysmateus superoxide, de Fe-SOD aanwezig in planten en andere andere organismen dan andere organismen dan zoogdieren, zijn Dimérrica-enzymen van identieke subeenheden, dat wil zeggen dat ze homodimeren zijn.
In sommige planten bevatten deze Fe-SOD een vermeende N-terminale signaalsequentie voor transport in het interieur van chloroplasten en andere bevatten een triqueer transport C-terminale sequentie naar peroxisomen, dus wordt aangenomen dat de subcellulaire verdeling ervan beide compartimenten beperkt is.
De moleculaire structuur van de drie soorten overexide-enzymen wordt in wezen geraadpleegd door alfa-propellers en bladen met B.
Functie
Dysmonisch superoxide verdedigt cellen, organen en lichaamsweefsels van schade dat zuurstofvrije radicalen kunnen veroorzaken hoe lipideperoxidatie, eiwitdenaturatie en mutagenese van het DNA.
Bij dieren kunnen deze reactieve soorten ook hartlaesies veroorzaken, veroudering versnellen en deelnemen aan de ontwikkeling van ontstekingsziekten.
Planten vereisen ook de essentiële enzymatische activiteit van overoxidedysmutase, omdat veel stressvolle omstandigheden van de omgeving de oxidatieve stress verhogen, dat wil zeggen de concentratie van schone reactieve soorten.
Bij mensen en andere zoogdieren hebben de drie isovormen die worden beschreven voor dysmutase overroxides verschillende functies. Het SOD2 -isoenzym, bijvoorbeeld, neemt deel aan celdifferentiatie en tumorogenese en ook aan bescherming tegen hyperoxie geïnduceerde longtoxiciteit (hoge zuurstofconcentratie).
Kan u van dienst zijn: inuline: structuur, eigenschappen, voedsel, contra -indicatiesVoor sommige soorten pathogene bacteriën functioneren SOD -enzymen als "virulentiefactoren" waarmee ze veel oxidatieve stressbarrières kunnen overwinnen waarvoor ze kunnen worden geconfronteerd tijdens het invasieproces.
Gerelateerde ziekten
Een afname van superoxidedysmutase -activiteit kan worden gegeven door verschillende factoren, zowel intern als extern. Sommige zijn gerelateerd aan directe genetische defecten in coderende genen voor SOD -enzymen, terwijl andere indirect kunnen zijn, gerelateerd aan de expressie van regulerende moleculen.
Groot aantal pathologische aandoeningen van mensen zijn gerelateerd aan SOD -enzymen, waaronder obesitas, diabetes, kanker en andere.
Met betrekking tot kanker is vastgesteld dat er een groot aantal soorten kankertumoren zijn met een lage niveaus van een van de drie superoxide van zoogdieren (SOD1, SOD2 en SOD3).
Oxidatieve stress die superoxide -dismutase -activiteit voorkomt, wordt ook geassocieerd met andere gewrichtspathologieën zoals artrose, reumatoïde artritis. Veel van deze ziekten hebben te maken met de expressie van factoren die SOD-activiteit remmen, zoals TNF-a-factor.
Referenties
- Fridovich, ik. (1973). Swiden dysmuta. Annu. Revisie. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Superoxide -dysmutes en de impact op de menselijke gezondheid. Aspecten van medicijnmoleculair, 26, 340-352.
- Oberley, l. W., & Bueftner, g. R. (1979). Rol van superoxide Distiny in Cancer: A Review. Kankeronderzoek, 39, 1141-1149.
- Taylor, p., Bowler, c., Kamperen, w. Van, Montagu, m. Van, Inzé, D., & Geroosterd, k. (2012). Superoxide afgewezen in planten. Kritische beoordelingen in plantenwetenschappen, 13(3), 37-41.
- Zelko, ik., Mariani, T., & Folz, r. (2002). Superoxide Distam Multigene Family: in vergelijking van de CUZN-SOD (SOD1), MN-SOD (SOD2) en EC-SOD (SOD3) genstructuren, evolutie en expressie. Free Radical Biology & Medicine, 33(3), 337-349.
- « Oligosaccharidenkenmerken, samenstelling, functies, typen
- José Rubén Romero Biography, Style, Works »

