Calciumsulfide (CAS) structuur, eigenschappen, verkrijgen, gebruik
- 4127
- 637
- Hugo Crooks
Hij Calciumsulfide Het is een anorganische vaste stof gevormd door het calcium (Ca) element en het zwavelelement (en), van chemische formule is CAS. Het is een geelachtig wit oplosbare vaste stof in water, die in de natuur in sommige vulkanen en in sommige meteorieten wordt gevonden in de vorm van een mineraal genaamd oldhamite.
Het CAS bij het oplossen in water vormt verschillende verbindingen omdat de zwavel ionen2- wordt ion sh- en oh ionen worden gevormd-. De resulterende oplossing is alkalisch. Deze verbinding wordt gebruikt als basis voor luminescente verbindingen of die zichtbaar licht produceren onder bepaalde omstandigheden. Deze materialen worden ook gebruikt in lichte schilderijen.
 CAS -calciumsulfide is in sommige meteorieten gevonden. Auteur: ррote жравёв. Bron: Pixabay.
CAS -calciumsulfide is in sommige meteorieten gevonden. Auteur: ррote жравёв. Bron: Pixabay. CAS is als mogelijke medicijnen beschouwd om hartproblemen en bloedvaten zoals hypertensie of hoge druk te behandelen, wat een ziekte is die een groot deel van de wereldbevolking treft.
Met calciumsulfide kunnen andere verbindingen zoals calciumnitraat en calciumcarbonaat worden verkregen. Het moet voorzichtig worden behandeld en in contact met het vocht van de atmosfeer kan h produceren2S die erg giftig is.
[TOC]
Structuur
Calciumsulfide is een zeer ionische verbinding gevormd door een CA -calciumion2+ en een sulfide -ionen2-.
Kristalliseren in een kubieke structuur zoals rotszout.
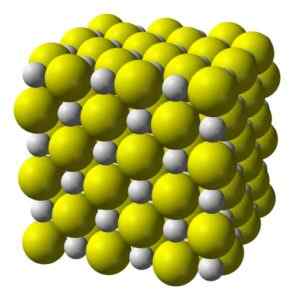 Kubische kristallijne structuur van calciumsulfide. Geel = zwavel; Wit = calcium. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons.
Kubische kristallijne structuur van calciumsulfide. Geel = zwavel; Wit = calcium. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons. Nomenclatuur
- Calciumsulfide
Fysieke eigenschappen
Fysieke staat
Geelachtig witte kristallijne vaste, kubieke kristallen zoals natriumchloride.
Molecuulgewicht
72,144 g/mol
Smeltpunt
2528 ºC
Dikte
2,59 g/cm3
Oplosbaarheid
Oplosbaar in water. Onoplosbaar in ethanol.
Chemische eigenschappen
Waterige oplossing
Bij het oplossen in water wordt de CAS gescheiden in zijn calciumcaionen 2+ en sulfide s2-. De laatste in water neemt een proton en wordt het shh -hydrosulfuro -ion- Een OH -hydroxylion vrijgeven-.
Kan u van dienst zijn: gezeefdS2- + H2Of ⇔ SH- + Oh-
Daarom zijn calciumsulfide -oplossingen alkalisch (ze hebben basis pH) en hebben geen sionen2- Maar SH-.
Alleen in het geval dat een grote hoeveelheid alkali wordt toegevoegd aan de oplossing zoals NaOH -natriumhydroxide. De balans beweegt naar de vorming van zwavelionen S2-.
 Calciumsulfide lost op in water dat andere verbindingen vormt. Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay.
Calciumsulfide lost op in water dat andere verbindingen vormt. Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay. De SH- Je kunt nog een proton haken h+ water, vormend waterstofsulfide, wat een zeer giftige verbinding is.
SH- + H2Of ⇔ h2S + OH-
Daarom vormen kleine hoeveelheden h in water2S en door te worden blootgesteld aan de vochtigheid van de omgeving, geeft de CAS een onaangename geur af die typisch is voor waterstofsulfide.
Verbindingen aanwezig bij het oplossen in water
Het resultaat van de eerder aangegeven waterreacties is dat Ca (SH) wordt gevormd2, CA (oh)2 en ca (sh) (oh).
CAS + H2O → Ca (sh) (oh)
Ca (sh) (oh) + h2O → CA (OH)2 + H2S
Zure reactie
Dezelfde reacties die in water optreden, laten de CAS reageren met zuren die h vormen2S.
CAS + 2 HCl → CACL2 + H2S
Andere reacties
Als een calciumsulfide -oplossing met zwavel wordt verwarmd, worden de polysulfide -ionen verkregen42- en s32-.
Als de CAS wordt verwarmd in droge lucht of zuivere zuurstof, wordt de verbinding geoxideerd tot calciumsulfietgeval3 En dan naar calciumsulfaat4:
2 CAS + 3 O2 → 2 Case3
2 Case3 + OF2 → 2 Case4
Met oxiderende middelen zoals KCLO -kaliumchloraat3, Kno kaliumnitraat3 of leiden dioxide2 Gewelddadige reacties treden op.
Het verkrijgen van
Calciumsulfide kan worden bereid door te berekenen (verwarming bij zeer hoge temperatuur) het calcium (Ca) en zwavel (s) in inerte atmosfeer, dat wil zeggen dat ze niet aanwezig zijn, bijvoorbeeld zuurstof- of waterdamp.
Het kan u van dienst zijn: chloorzuur (HCLO2)Ca + s + warmte → cas
Kan ook worden verkregen door calciumsulfaatkoffer te verwarmen4 Met steenkool:
Geval4 + 2 C → CAS + 2 CO2
In het laatste geval wordt echter geen puur huis verkregen, omdat het bovendien met de case reageert4 Cao vormen en zo2.
CAS wordt ook gegenereerd door het verbranden van kolenverspilling.
Aanwezigheid in de natuur
De CAS is van nature aanwezig in het Oldhamite Mineral. Dit is een onderdeel van sommige meteorieten en is belangrijk door het wetenschappelijke onderzoek dat op het zonnestelsel wordt uitgevoerd.
Er wordt aangenomen dat de Oldhamita werd gevormd door condensatie in de nevel die het zonnestelsel ontstond. Het is ook aanwezig in vulkanen.
 CAS -calciumsulfide bevindt zich in het Oldhamite -mineraal, dat in sommige meteorieten is gevonden. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
CAS -calciumsulfide bevindt zich in het Oldhamite -mineraal, dat in sommige meteorieten is gevonden. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. Bovendien wordt calciumsulfide van nature geproduceerd door de vermindering van de zaak4 (gips) mogelijk door de werking van bacteriën.
Toepassingen
In lichte materialen
Een van de meest voorkomende toepassingen van calciumsulfide is als basis voor lichtverbindingen. Dit zijn stoffen die zichtbaar licht uitzenden onder bepaalde omstandigheden.
In de lichtgevende verbindingen van CAS werkt dit als basis en worden activatoren toegevoegd aan de structuur zoals chloriden van bepaalde elementen zoals cerio (CE3+) en Europio (EU2+)).
Het materiaal dat het gevolg is van de CAS -unie en de activator wordt bijvoorbeeld gebruikt in kathodestraalbuizenschermen die de oude schermen van computers of computers of oude tv -apparaten vormen.
 Oude computers Monitors hadden kathodestraalbuizen waarin soms luminescente verbindingen van calciumsulfide en activatoren soms worden gebruikt. Auteur: Andreas160578. Bron: Pixabay.
Oude computers Monitors hadden kathodestraalbuizen waarin soms luminescente verbindingen van calciumsulfide en activatoren soms worden gebruikt. Auteur: Andreas160578. Bron: Pixabay. Ze worden ook gebruikt in de huidige lampen van licht die diodes uitzenden of LED (acroniem voor Engels Lichtgevende dioden)).
Kan u van dienst zijn: ayaroína LED lamp. Sommigen kunnen luminescente verbindingen van calciumsulfide bevatten. Geen machine-leesbare auteur verstrekt. Apper veronderstelde (op basis van auteursrechtclaims). /Cc by-sa (http: // creativeCommons.Org/licenties/by-sa/3.0/). Bron: Wikimedia Commons.
LED lamp. Sommigen kunnen luminescente verbindingen van calciumsulfide bevatten. Geen machine-leesbare auteur verstrekt. Apper veronderstelde (op basis van auteursrechtclaims). /Cc by-sa (http: // creativeCommons.Org/licenties/by-sa/3.0/). Bron: Wikimedia Commons. Deze materialen worden ook gebruikt in lichte schilderijen en vernissen.
In de geneeskunde
Calciumsulfide is in medische studies beschouwd als een medicijn om arteriële hypertensie te behandelen (hoge druk in slagaders). Dit is een ziekte die het cardiovasculaire systeem van veel mensen (hart- en bloedvaten) beïnvloedt.
CAS wordt beschouwd als een "donor" van H2S. Dit speelt een belangrijke rol bij het reguleren van de toon of sterkte van bloedvaten, dus de CAS -administratie kan een mogelijke remedie zijn om hypertensie te behandelen.
 Calciumsulfide is bestudeerd als een mogelijke remedie voor de hoge druk van het cardiovasculaire systeem van zieke mensen. Auteur: Mohamed Hassan. Bron: Pixabay.
Calciumsulfide is bestudeerd als een mogelijke remedie voor de hoge druk van het cardiovasculaire systeem van zieke mensen. Auteur: Mohamed Hassan. Bron: Pixabay. Bij het verkrijgen van andere verbindingen
Calciumsulfide maakt het mogelijk om andere verbindingen te bereiden, zoals calciumnitraat Ca (nee3))2:
CAS + 2 HNO3 → CA (nee3))2 + H2S
Het is ook gebruikt om calciumcarbonaat te verkrijgen3. Hiervoor wordt een waterige oplossing van CAS aan steenkool voorgelegd2:
CAS + H2Of + co2 → h2S + Caco3
Andere apps
Calciumsulfide wordt ook gebruikt als additief voor smeermiddelen en als een flotatie -middel bij minerale extractie.
Risico's
Calciumsulfide kan huid, ogen en luchtwegen irritatie veroorzaken. Moet worden gemanipuleerd met voorzorgsmaatregelen en de juiste beveiligingswerktuigen.
Het is een zeer giftige verbinding voor het waterleven, dus het is gevaarlijk voor deze omgevingen.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Lead, D.R. (editor). (2005). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Ropp, r.C. (2013). Groep 16 (O, S, SE, TE) Alkalische aardverbindingen. Sulfide calcium. In encyclopedie van de alkalische aardverbindingen. Hersteld van Scientedirect.com.
- Li, en.F. et al. (2009). Calciumsulfide (CAS), voor donor van waterstofsulfide (H (2) S): een nieuwe antihypertensieve drarug? Med Hypothes, 2009 Sep; 73 (3): 445-7. NCBI hersteld.NLM.NIH.Gov.
- Huis j.EN. en huis, k.NAAR. (2016). Zwavel, selenium en tellurium. Voorkomen in zwavel. In beschrijvende anorganische chemie (derde editie). Hersteld van Scientedirect.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Calciumsulfide. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Bier, m. et al. (2014). Conversie van calciumsulfide naar calciumcarbonaat tijdens het herstel van elementaire zwavel door gipsafval. Waste Manag, 2014 nov; 34 (11): 2373-81. NCBI hersteld.NLM.NIH.Gov.
- « Kwantitatieve onderzoekskenmerken, technieken, voorbeelden
- Calciumsilicaateigenschappen, structuur, verkrijgen, gebruik »

