Aluminium sulfide (AL2S3) structuur, eigenschappen, gebruik
- 4747
- 1429
- Aaron Okuneva
Hij Aluminiumsulfide (Naar de2S3) Het is een lichtgrijze chemische verbinding gevormd door de oxidatie van metaalaluminium bij het verliezen van de elektronen van het laatste niveau van energie en een kation worden, en door de vermindering van niet -metalen zwavel, door elektronen te verkrijgen die door aluminium worden overgebracht en een anion worden en een anion worden en een anion worden en een anion worden en een anion worden en een anion worden en een anion worden en een anion worden.
Om dit te laten gebeuren en aluminium zijn elektronen kan opleveren, is het noodzakelijk dat u drie hybride orbitalen SP presenteert3, die de mogelijkheid geven om links te vormen naar elektronen van zwavel.
Wateraluminiumsulfidegevoeligheid houdt in dat het in aanwezigheid van waterdamp in de lucht kan reageren met het produceren van aluminiumhydroxide (AL (OH)3), waterstofsulfide (h2S) en waterstof (h2) gasvormig; Als deze laatste zich ophoopt, kan een explosie veroorzaken. Daarom moet aluminiumsulfide -verpakkingen worden gedaan met behulp van hermetische containers.
Aan de andere kant, aangezien aluminiumsulfide reactiviteit heeft met water, maakt dit het een element dat geen oplosmiddel heeft.
Chemische structuur
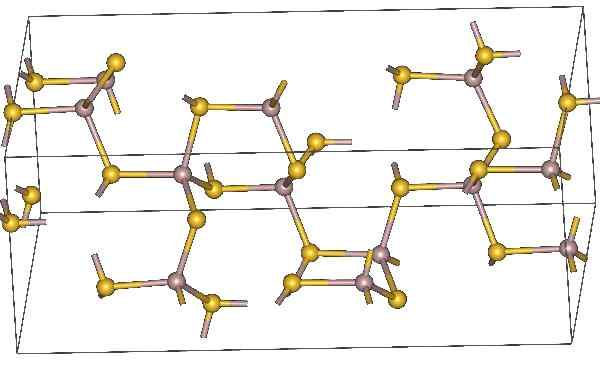
 Chemische structuur van aluminiumsulfide. Gele atomen vertegenwoordigen zwavel. Bron: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons
Chemische structuur van aluminiumsulfide. Gele atomen vertegenwoordigen zwavel. Bron: MaterialScientist, CC BY-SA 3.0, via Wikimedia Commons Moleculaire formule
Naar de2S3
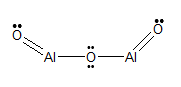
Structurele Formule
 Nomenclatuur
Nomenclatuur
- Aluminiumsulfide.
- Di aluminium trisulfide.
- Aluminium sulfide (III).
- Aluminiumsulfide.
Aluminium sulfide -eigenschappen
 Aluminium sulfide -uiterlijk
Aluminium sulfide -uiterlijk Chemische verbindingen vertonen meestal twee soorten eigenschappen: fysische en chemische stof.
Fysieke eigenschappen
Molaire massa
150,158 g/mol
Dikte
2.02 g/ml
Smeltpunt
1100 ° C
Oplosbaarheid in water
Onoplosbaar
Chemische eigenschappen
Een van de belangrijkste reacties van aluminiumsulfide is met water, zoals substraat of hoofdreactief:

In deze reactie kan de vorming van aluminiumhydroxide en die van waterstofsulfide worden waargenomen als deze in de vorm van gas of sulfidezuur is als deze in het water wordt opgelost in de vorm van een oplossing. Zijn aanwezigheid wordt geïdentificeerd door de geur van rotte eieren.
Kan u van dienst zijn: chemische oplossingenGebruik en toepassingen
In super cardpisors
Aluminiumsulfide wordt gebruikt bij de productie van nano -nettenstructuren die het specifieke oppervlak en de elektrische geleidbaarheid verbeteren, zodat een hoge capaciteit en energiedichtheid kan worden bereikt waarvan de toepasbaarheid die van supercaugades is.
Grafeenoxide (GO) - Grafeen is een van de alotrope vormen van koolstof - heeft gediend als een aluminiumsulfide -ondersteuning (AL2S3) Met een hiërarchische morfologie vergelijkbaar met die van nanorambután vervaardigd met behulp van de hydrothermische methode.
Grapheenoxide -werking
De kenmerken van grafeenoxide als ondersteuning, evenals een hoge elektrische geleidbaarheid en oppervlakte, maken de nanorambutaan2S3 elektrochemisch actief zijn.
De specifieke CV -capaciteitscurves met goed gedefinieerde redox -pieken bevestigen het pseudocapacitieve gedrag van het nanorambutaan2S3 hiërarchisch, ondersteund in grafeenoxide in NaOH 1M elektrolyt. De specifieke CV -capaciteitswaarden verkregen uit de krommen zijn: 168.97 met de verkenningssnelheid van 5 mV/s.
Bovendien is een goede galvanostatische ontladingstijd van 903 µs waargenomen, een grote specifieke capaciteit van 2178.16 tot de stroom van 3 ma/cm stroom2. De energiedichtheid berekend uit de galvanostatische ontlading is 108,91 WH/kg, tot de stroomdichtheid van 3 ma/cm2.
Elektrochemische impedantie bevestigt dus de pseudocapacitieve aard van de hiërarchische nanorambutane -elektrode naar de2S3. De elektrode -stabiliteitstest toont een behoud van 57,84 % van de specifieke capaciteit van maximaal 1000 cycli.
Experimentele resultaten suggereren dat nanorambutane2S3 Hiërarchisch is geschikt voor supercaiding -toepassingen.
Kan u dienen: chroomhydroxide: structuur, eigenschappen, synthese, gebruikIn secundaire lithiumbatterijen
Met de bedoeling om een secundaire lithiumbatterij te ontwikkelen met een hoge energiedichtheid, werd aluminiumsulfide bestudeerd (AL2S3) als actief materiaal.
De eerste meetmaatregel met downloadcapaciteit2S3 Het was ongeveer 1170 mAh G-1 tot 100 m G-1. Dit komt overeen met 62 % van de theoretische capaciteit voor sulfide.
De Al2S3 Hij vertoonde een slechte capaciteitsretentie in het potentiële bereik tussen 0,01 V en 2,0 V, voornamelijk vanwege de structurele onomkeerbaarheid van het laadproces of de extractie van Li.
XRD- en K-XES-analyse voor aluminium en zwavel gaf aan dat het oppervlak van Al2S3 reageert omkeerbaar tijdens het laden en lossen van processen, terwijl de kern van Al2S3 Hij vertoonde structurele onomkeerbaarheid, omdat Lial en Li2S werden gevormd uit Al2S3 In de eerste download en toen bleven ze zoals ze waren.
Risico's
- In contact met water komt ontvlambare gassen af die spontaan kunnen verbranden.
- Huidirritatie veroorzaken.
- Ernstige oculaire irritatie veroorzaken.
- Kan ademhalingsirritatie veroorzaken.
Informatie kan variëren tussen meldingen, afhankelijk van onzuiverheden, additieven en andere factoren.
EHBO -procedure
Algemene behandeling
Zoek naar medische hulp als de symptomen aanhouden.
Speciale behandeling
Geen
Belangrijke symptomen
Geen
Inademing
Neem het slachtoffer mee naar buiten. Lever zuurstof als ademhaling moeilijk is.
Inname
Beheer een of twee glazen water en veroorzaken braken. Induceer nooit braken of geef iets in de mond aan een onbewuste persoon.
Bond
Was het getroffen gebied met zachte zeep en water. Verwijder eventuele vervuilde kleding.
Ogen
Was je ogen met water en knippert vaak enkele minuten. Verwijder contactlenzen voor het geval u ze hebt en blijf spoelen.
Het kan u van dienst zijn: Cruise for Crucible: Kenmerken, functies, gebruik voorbeeldenBrandbestrijdingsmaatregelen
Ontsteking
Niet ontvlambaar.
Middelen van uitsterven
Reageren met water. Gebruik geen water: gebruik Co₂, Sand en Dust Deplusse.
Vechtprocedure
Gebruik een autonoom ademhalingsapparaat met volledige bescherming. Draag kleding om contact met huid en ogen te voorkomen.
Referenties
- Gezondheid en risico's.com, (s.f), definitie, concepten en artikelen over gezondheid, risico's en milieu. Ontvangen: gezondheid en risico's.com
- Aluminiumsulfide. (S.F). In Wikiwand. Ontvangen op 9 maart 2018: Wikiwand.com
- Webelementen.(S.F).Dialuminium trisulpfide, hersteld op 10 maart 2018: WebElements.com
- LTS Research Laboratories, Inc (2016), Veiligheidsgegevensblad Aluminiumsulfide: Ltschem.com

