Mangaansulfaat (MNSO4) structuur, eigenschappen, verkrijgen, gebruik

- 3174
- 1015
- Irving McClure I
Hij Mangaansulfaat (II) Het is een anorganische vaste stof gevormd door de mangaan -elementen (MN), zwavel (s) en zuurstof (O). De chemische formule is MSO4. Zijn watervrije vorm (zonder water in zijn structuur) is een witte vaste stof. Het heeft echter verschillende gehydrateerde vormen en ze zijn allemaal roze vaste stoffen.
Mangaansulfaat in zeer kleine (kleine) hoeveelheden wordt gebruikt als micronutriënt voor zowel dieren als mensen, omdat het nodig is voor de normale werking van het organisme.
 Mangaansulfaat Anhidro MNSO4. YOSF0113 bij het Engels Wikipedia / Public Domain. Bron: Wikimedia Commons.
Mangaansulfaat Anhidro MNSO4. YOSF0113 bij het Engels Wikipedia / Public Domain. Bron: Wikimedia Commons. Het wordt ook bij elkaar opgeteld met bepaalde meststoffen in gebrekkige bodems in mangaan (MN) voor landbouwgewassen die het nodig hebben, zoals druivenplanten.
Vanwege de roze kleuring van zijn gehydrateerde variëteiten, wordt het gebruikt in pigmenten die dienen om keramiek te schilderen, stoffen en andere materialen kleur te schilderen. Het dient ook om andere mangaanverbindingen te verkrijgen.
De mons4 moet zorgvuldig worden gemanipuleerd. De inademing ervan kan ademhalingsproblemen veroorzaken en ernstige ongemakken veroorzaken in het zenuwstelsel, waaronder symptomen die vergelijkbaar zijn met de ziekte van Parkinson.
Het overtollige kan ook schade veroorzaken aan land- en waterdieren en planten.
[TOC]
Structuur
Watervrij mangaansulfaat (zonder water in zijn kristallijne structuur) wordt gevormd door een mangaanion in oxidatie +2, dat wil zeggen mn2+ en een sulfaatanion dus42-.
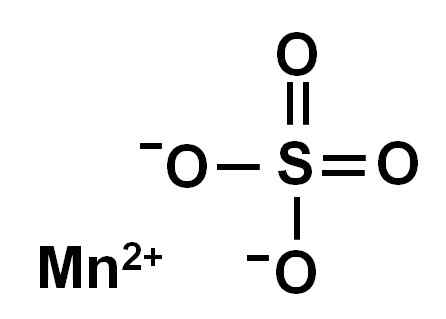 Chemische structuur van mangaansulfaat4. Auteur: Marilú Stea.
Chemische structuur van mangaansulfaat4. Auteur: Marilú Stea. Nomenclatuur
- Mangaansulfaat (II)
- Mangaanmonosulfaat
- Mangaansulfaat Anhidro MNSO4
- Mangaan mangaansulfaat MSSO4 •H2OF
- Tetrahydraat mangaansulfaat MSO4 •4h2OF
- Mangaansulfaat pentahydrate4 •5h2OF
- Hepthydrated mangaansulfaat4 •7h2OF
Eigenschappen
Fysieke staat
De mons4 watervrij (zonder water in zijn structuur) is een kristallijne witte vaste stof. Gehydrateerde variëteiten zijn echter roze of lichtrode vaste stoffen.
 Manganes sulfaat tetrahydraat mnso4.4h2Of is een roze solide. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons.
Manganes sulfaat tetrahydraat mnso4.4h2Of is een roze solide. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons. Molecuulgewicht
MSSO4 = 151 g/mol
MSSO4 •H2O = 169.02 g/mol
Smeltpunt
Watervrij MSSO4 = 700 ºC
Monohydraat MSO4 •H2O = 400-450 ° C
Menso -tetrahydraat4 •4h2O = 30 ° C
Kookpunt
Watervrij MSSO4 = Het ontleedt bij 850 ºC.
Het kan u van dienst zijn: Cobalt -chloride (COCL2 (: Structuur, Nomenclatuur, EigenschappenMenso -tetrahydraat4 •4h2O = 850 ° C
Dikte
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Oplosbaarheid
Zeer oplosbaar in water: 52 g/100 ml water bij 5 ° C. Oplosbaar alcohol. Onoplosbaar in ether. Enigszins oplosbaar in methanol.
pH
Een MONSE -oplossing4 •H2Of 5% heeft een pH van 3,7.
Chemische eigenschappen
Bij het oplossen in water wordt de MNSO4 gescheiden in zijn Mn -ionen2+ En dus42-.
Het mangaanion (ii) mn2+ In zure of neutrale oplossing is het gekoppeld aan 6 watermoleculen2Of het vormen van het hexaacuomanganese ionen [mn (h2OF)6]2+, die roze is.
De hexaacuomanganese ionen [mn (h2OF)6]2+ Het is vrij bestand tegen oxidatie. In basismedium (alkalische pH) wordt dit ion mangaanhydroxide (II) Mn (OH)2, die gemakkelijk wordt geoxideerd en mangaanverbindingen (III) en mangaan (IV) vormt.
 MSSO -oplossingen4 zuren zijn roze door de aanwezigheid van de hexaacuomanganese ionen [mn (h2OF)6]2+. Auteur: Steve Cross. Bron: Pixabay.Mangaansulfaat heeft verschillende gehydrateerde vormen, dat wil zeggen met water h2Of in zijn kristallijne structuur.
MSSO -oplossingen4 zuren zijn roze door de aanwezigheid van de hexaacuomanganese ionen [mn (h2OF)6]2+. Auteur: Steve Cross. Bron: Pixabay.Mangaansulfaat heeft verschillende gehydrateerde vormen, dat wil zeggen met water h2Of in zijn kristallijne structuur.
Dit zijn monohydraat MSO4 •H2Of, tetrahydraat MSO4 •4h2Of, mnse pentahydrate4 •5h2O en hepthydraat MSO4 •7h2OF. Deze gehydrateerde vormen bevatten de hexaacuomanganese ionen [mn (h2OF)6]2+ In hun kristallen en om deze reden zijn ze roze vaste stoffen.
De monohydraatmenso4 •H2Of het is enigszins efflorescerend, wat betekent dat het een deel van zijn hydratatiewater langzaam verliest wanneer het wordt blootgesteld aan de omgeving.
Het verkrijgen van
De mons4 kan worden verkregen door mangaanoxide (II) Mno, Mn Manghanous Hydroxide (OH) te behandelen2 o Mangaancarbonaat (II) MNCO3 Met zwavelzuur h2SW4.
MNCO3 + H2SW4 → MSSO4 + H2Of + co2
Toepassingen
Als een voedingscomplement
Mangaansulfaat in kleine hoeveelheden dient bepaalde functies van het menselijk lichaam en dieren.
Daarom is het belangrijk als een nuttige verbinding in voeding en wordt het geleverd als een voedingssupplement. Het wordt gebruikt in sporen (extreem kleine hoeveelheden).
Hoge hoeveelheden kunnen zeer giftig en schadelijk zijn.
In veterinaire geneeskunde
De mons4 Corral -vogels (kippen, kalkoenen, eenden en Phaisanes) worden toegediend om het tekort of het gebrek aan mangaanelement bij deze dieren te voorkomen.
Kan je van dienst zijn: kaliumjodaat (kio3)Mangaangebrek manifesteert zich bijvoorbeeld als de ziekte die perosis wordt genoemd, wat de vervorming is van de botten van jonge vogelpoten.
 Patito's kunnen Monste -sporen vereisen4 In zijn dieet om perose te voorkomen. Auteurs: S. Hermann & F. Richter. Bron: Pixabay.
Patito's kunnen Monste -sporen vereisen4 In zijn dieet om perose te voorkomen. Auteurs: S. Hermann & F. Richter. Bron: Pixabay. Het is van toepassing op het voeren van deze vogels in zeer kleine hoeveelheden of sporen.
In de landbouw
Mangaansulfaat wordt gebruikt als een micronutriënt bij meststoffen voor wijnstokken (druivenplanten) en tabaksplantages in deficiënte ladders in mangaan.
Sommige onderzoeken geven echter aan dat overtollig mangaansulfaat de vorming van bepaalde belangrijke enzymen voor de groei van planten en hun uitbraken kan belemmeren of verminderen.
 In sommige gevallen past het MNSO toe4 op de grond waar druivenplanten zijn. Auteur: Schwoaze. Bron: Pixabay.
In sommige gevallen past het MNSO toe4 op de grond waar druivenplanten zijn. Auteur: Schwoaze. Bron: Pixabay. Er is bijvoorbeeld gebleken dat het giftig is voor sommige gewassen zoals katoen.
De mons4 Het heeft ook gebruik in fungiciden en samen met bepaalde organische verbindingen maakt deel uit van bepaalde pesticiden.
In verschillende toepassingen
De mons4 Hydrated wordt door de kleur gebruikt om anorganische pigmenten te bereiden die worden gebruikt in rode vernissen voor keramiek, in stoffen en andere materiaalverf.
Mangaansulfaat wordt gebruikt in de productie van glas en zepen worden er ook mee bereid.
 Sommige keramische tegels kunnen mangaansulfaatpigmenten bevatten. Auteur: Dwilliams. Bron: Pixabay.
Sommige keramische tegels kunnen mangaansulfaatpigmenten bevatten. Auteur: Dwilliams. Bron: Pixabay. De mons4 Het is het uitgangsmateriaal om het mangaanmetaal (Mn) elektrolytisch te verkrijgen, dat wil zeggen door elektriciteit toe te passen op waterige oplossingen.
Hiermee kunt u ook mangaan -dioxide verkrijgen2 en mangaancarbonaat3.
De mons4 Het wordt ook gebruikt voor chemische analyse en bij de formulering van oplossingen die worden gebruikt in genetica -experimenten met micro -organismen.
Risico's
Mangaansulfaat bevat het mangaanion (II) (Mn2+), die zowel onschadelijk als giftig kan zijn, afhankelijk van de hoeveelheden waaraan de persoon, het dier of de plant wordt blootgesteld.
Mangaan is essentieel voor de normale werking van het organisme van mensen, dieren en sommige planten. Maar helaas is mangaan ook neurotoxisch, dat wil zeggen, het beïnvloedt het zenuwstelsel en sommige plantenfuncties.
Kan u van dienst zijn: wie heeft de eerste moderne thermometer ontworpen?Schijnbaar veilige bedragen
De mons4 Beheerd met voedselvormige voedsel (extreem kleine of kleine hoeveelheden) is over het algemeen veilig door voedsel- en medicatiebeheer, of FDA (acroniem voor Engels Food and Drug Administration)).
Gevaarlijke hoeveelheden
Langdurige of herhaalde blootstelling aan deze verbinding in aanzienlijke hoeveelheden kan schade toebrengen aan de mens en dieren.
Het produceert irritatie in de slijmvliezen en slijmvliezen van de luchtwegen, anorexia, hoofdpijn, verlies van evenwicht, longontsteking en luchtweginfecties.
Chronische inhalatie veroorzaakt schade aan het zenuwstelsel, het genereren van manganisme, tremor in de typische handen en symptomen van de ziekte van Parkinson.
 Mangaansulfaat beïnvloedt het zenuwstelsel. Auteur: Sabine Zierer. Bron: Pixabay.
Mangaansulfaat beïnvloedt het zenuwstelsel. Auteur: Sabine Zierer. Bron: Pixabay. Daarom moet de dispersie van MSO -stof worden vermeden4, Gebruik ademhalingsapparatuur en beschermende handschoenen.
Het is giftig voor het waterleven en genereert hierin langetermijneffecten. Het moet worden opgeslagen op plaatsen waar er geen toegang is tot de drainage- of rioolsysteem. Het is heel belangrijk om niet toe te staan dat het in de omgeving wordt weggegooid.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Sulfaatmangaan. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. Deel A22. VCH VerlagSgellschaft MBH.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Mangaansulfaatmonohydraat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Dunham, m.J. (2010). Gids voor Yast -genetica: functionele genomics, proteomics en andere systeemanalyse. Middelgrote formulering. In methoden in enzymologie. Hersteld van Scientedirect.com.
- Saric, m. en Lucchini, r. (2007). Mangaan. Je gebruikt. In Handbook on the Toxicology of Metals (derde editie). Hersteld van Scientedirect.com.
- Vallero, D. (2014). Neurologische effecten van luchtpolutanten. Mangaan. In fondsen van luchtvervuiling (vijfde editie). Hersteld van Scientedirect.com.
- Chee, r. (1986). In vitro Cultuur van Vitis: De effecten van lichtspectrum mangaansulfaat en kaliumjodide op morfogenese. Plantcel, Tiss and Organ Cult 7: 121-134 (1986). Link hersteld.Springer.com.
- « Secbutil structuur, kenmerken, nomenclatuur, training
- +125 korte en populaire uitspraken [met betekenis] »

