Kopersulfaat (CUSO4) structuur, eigenschappen, verkrijgen, gebruik
- 3291
- 686
- Nathan Wiegand
Hij kopersulfaat Het is een anorganische verbinding gevormd door het koper (Cu), zwavel (s) en zuurstof (O) elementen (O). De chemische formule is CUSO4. Het koper bevindt zich in een staat van oxidatie +2, zwavel +6 en zuurstof heeft Valencia -2.
Het is een witte vaste stof dat wanneer het wordt blootgesteld aan de vochtigheid van de omgeving zijn Cuso Blue Pentahydraat wordt4 •5h2OF. De witte vaste stof wordt verkregen door het blauw te verwarmen om het water te elimineren.
 Kopersulfaat (Cuo4) watervrij (zonder water in zijn kristallijne structuur). W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons.
Kopersulfaat (Cuo4) watervrij (zonder water in zijn kristallijne structuur). W. Oelen/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0). Bron: Wikimedia Commons. Het wordt al eeuwenlang gebruikt als antibacterieel middel om wonden bij mensen en dieren te genezen. Het werkt ook als een fungicide, als een samentrekkende, antidiarrheal en controlerende darmziekten bij dieren. Het wordt ook gebruikt als een antihongos -middel in planten.
Een deel van hun gebruik is echter stopgezet omdat hun overtollige giftig kan zijn voor zowel mensen, dieren als planten. Het concentratiesinterval waarin het kan worden gebruikt, is smal en hangt af van de soort.
Het wordt gebruikt als een katalysator in chemische reacties en als oplosmiddelen die het zijn. Het maakt het mogelijk om de weerstand en flexibiliteit van sommige polymeren te verbeteren.
Overmatige hoeveelheden van deze verbinding kunnen schadelijk zijn voor de bodem, omdat het giftig is voor micro -organismen die gunstig zijn voor planten.
[TOC]
Structuur
Kopersulfaat wordt gevormd door een koperion (Cu2+) en een sulfaat -ion (dus42-)).
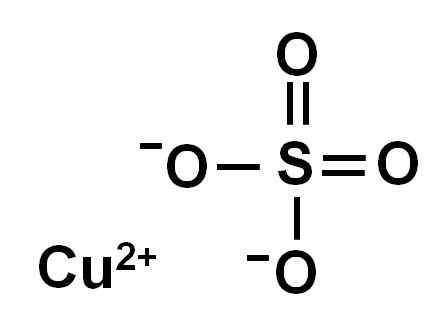 Ionica kopersulfaat (ii). Auteur: Marilú Stea.
Ionica kopersulfaat (ii). Auteur: Marilú Stea. Vanwege het verlies van twee elektronen heeft het koperion (II) de volgende elektronische conformatie:
1s2 2s2 2 p6 3S2 3P6 3D9
Het is te zien dat het orbitaal heeft 3D onvolledig (heeft 9 elektronen in plaats van 10).
Nomenclatuur
- Watervrij kopersulfaat
- Kopersulfaat (II)
- Cupric sulfaat
Eigenschappen
Fysieke staat
Groenachtig witte vaste stof of kristalvormige.
Molecuulgewicht
159.61 g/mol
Smeltpunt
Bij 560 ºC breekt het af.
Dikte
3,60 g/cm3
Oplosbaarheid
22 g/100 g water bij 25 ° C. Onoplosbaar in ethanol.
Chemische eigenschappen
Wanneer het wordt onderworpen aan het vocht van de lucht onder 30 ° C, wordt het de Cuso Pentahydraat -verbinding4 •5h2OF.
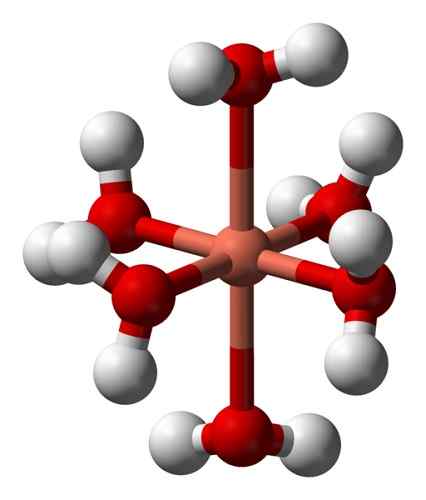
De waterige oplossingen zijn blauw vanwege de vorming van het hexaacuocoobre -ion (ii) [cu (h2OF)6]2+ die zo'n kleur veroorzaakt. In dit ion zijn twee van de watermoleculen verder van het metalen atoom dan de andere vier.
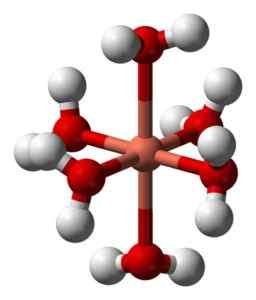 Vervormde structuur van het hexaacuocobre -ion (ii) [cu (h2OF)6]2+. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons.
Vervormde structuur van het hexaacuocobre -ion (ii) [cu (h2OF)6]2+. Benjah-BMM27 / Public Domain. Bron: Wikimedia Commons. Dit komt door het zogenaamde Jahn-Teller-effect, dat voorspelt dat dit type systemen de vervorming ervaart die wordt veroorzaakt door het feit dat de Cu2+ Het heeft een elektronische structuur die eindigt in D9, dat wil zeggen, een onvolledig orbitaal (het zou compleet zijn als het D zou zijn10)).
Kan u van dienst zijn: calciumhydroxide (ca (oh) 2): structuur, eigenschappen, verkrijgen, gebruikAls ammoniak wordt toegevoegd (NH3) Deze oplossingen worden gevormd waarin de NH3 Watermoleculen is achtereenvolgens verplaatst. Ze worden bijvoorbeeld gevormd van [Cu (NH3) (H2OF)5]2+ Tot [Cu (NH3))4(H2OF)2]2+.
Wanneer de CUSO4 Het wordt verwarmd tot zijn ontleding stoten giftige gassen uit en wordt cupricoxide.
Het verkrijgen van
Watervrij kopersulfaat kan worden verkregen door totale uitdroging van de pentahydraatverbinding, die wordt bereikt door het te verwarmen totdat de watermoleculen verdampen.
Cuso4 •5h2O + warmte → cuo4 + 5 H2Of ↑
De pentahydraatverbinding is blauw, dus het Cuso -water wordt verkregen bij het verliezen van het kristallisatiewater4 Wit watervrij.
Toepassingen
Een deel van de toepassingen overlappen elkaar met die van de pentahydraatverbinding. Anderen zijn specifiek voor watervrije substantie.
Als antibacterieel middel
Het heeft potentieel als een antimicrobieel middel. Het wordt al duizenden jaren gebruikt, zelfs in culturen van Zuid -Amerika en Midden -Amerika, om wondinfectie te voorkomen door gaas geïmpregneerd in een oplossing van deze verbinding.
Geschat wordt dat in het mechanisme van zijn antibacteriële activiteit de ionen cu2+ Ze vormen chelaten met enzymen die cruciaal zijn voor de cellulaire functies van bacteriën, waardoor ze deactiveren. Ze induceren ook de vorming van hydroxylradicalen OH •, die de bacteriemembranen en hun DNA beschadigen.
 De CUSO4 Het kan werken tegen sommige pathogene bacteriën. Auteur: Gerd Altmann. Bron: Pixabay.
De CUSO4 Het kan werken tegen sommige pathogene bacteriën. Auteur: Gerd Altmann. Bron: Pixabay. Onlangs is gemeld dat CUSO sporen4 Ze kunnen de antimicrobiële activiteit van natuurlijke producten verhogen die rijk zijn aan polyfenolen, zoals granaatextracten en infusies van sommige soorten theeplanten.
In veterinaire toepassingen
Het wordt gebruikt als een antiseptisch en samentrekkend voor slijmvliezen en om externe conjunctivitis en otitis te behandelen. Het dient om therapeutische of profylactische baden uit te voeren om rot van vee, schapen en andere zoogdieren te voorkomen.
 Cuo waterige oplossingen4 Ze dienen om vee -gaten te genezen. Auteurs: Ingrid und Stefan Melichar. Bron: Pixabay.
Cuo waterige oplossingen4 Ze dienen om vee -gaten te genezen. Auteurs: Ingrid und Stefan Melichar. Bron: Pixabay. Het dient als een bijtend middel voor necrotische massa's in de extremiteiten van vee, stomatitiszweren en gegranuleerd weefsel hiervan. Het heeft gebruik als een fungicide bij de behandeling van kleurstof en ziekten veroorzaakt door huidschimmels.
Het wordt ook gebruikt als een emético (agent om braaksel uit te lokken) bij varkens, honden en katten; Als antidiarrheal samentrekkend voor kalveren en om darmmoniliasis in pluimvee en kalkoen trichomoniasis te beheersen.
Als een diervoedersupplement
Kopersulfaat is gebruikt als een supplement in zeer kleine hoeveelheden voor het voeden van vee, varkens en pluimvee. Het dient om koperen tekort bij herkauwers te behandelen. In het geval van varkens en vogels wordt het gebruikt als een groeistimulans.
Kan u van dienst zijn: chromatogramKoper is geïdentificeerd als essentieel voor de biosynthese van hemoglobine bij zoogdieren, cardiovasculaire structuur, synthese van het botcollageen, enzymsystemen en reproductie.
Zoals vermeld in de vorige paragraaf, kan het ook worden geleverd als medicatie voor ziektebestrijding. Suppletie en/of medicatieniveaus moeten echter met zorg worden gecontroleerd.
 Knalvogels en hun eieren kunnen worden beïnvloed door een overtollig kopersulfaat in hun dieet. Auteur: Pexels. Bron: Pixabay.
Knalvogels en hun eieren kunnen worden beïnvloed door een overtollig kopersulfaat in hun dieet. Auteur: Pexels. Bron: Pixabay. Van een bepaalde hoeveelheid, die van elke soort afhangt, kan een afname van groei, verlies van eetlust en gewicht, schade aan bepaalde organen en zelfs de dood van dieren optreden.
Bij kippen bijvoorbeeld vermindert de suppletie van 0,2% of meer de inname van het voedsel hiervan met het daaruit voortvloeiende gewichtsverlies, verminderde eierproductie en de dikte van hun schillen.
In agrarische toepassingen
In organische productiesystemen is het niet toegestaan om synthetische fungiciden te gebruiken, alleen koper- en zwavelproducten worden geaccepteerd, zoals kopersulfaat.
Bijvoorbeeld bepaalde schimmels die appelplanten aanvallen, zoals Venturia inaequalis, worden geëlimineerd met deze verbinding. Er wordt gedacht dat mogelijk de ionen cu2+ Ze zijn in staat om de schimmelspore binnen te gaan, eiwitten te denaturaliseren en verschillende enzymen te blokkeren.
 Kopersulfaat dient om sommige schimmels te bestrijden die appels aanvallen. Algirdas op LT.Wikipedia / Public Domain. Bron: Wikimedia Commons.
Kopersulfaat dient om sommige schimmels te bestrijden die appels aanvallen. Algirdas op LT.Wikipedia / Public Domain. Bron: Wikimedia Commons. Het belang van koper in planten
Het koperelement is belangrijk in fysiologische processen van planten zoals fotosynthese, ademhaling en verdediging tegen antioxidanten. Zowel het tekort aan dit element als zijn overmaat genereren reactieve geoxygeneerde soorten die schadelijk zijn voor de moleculen en structuren hiervan.
Het interval van de koperconcentraties voor optimale groei en ontwikkeling van planten is erg smal.
Nadelige effecten op de landbouw
Wanneer dit product overdreven wordt gebruikt in landbouwactiviteiten, kan het fytotoxisch zijn, voortijdig fruitontwikkeling veroorzaken en zijn kleur veranderen.
Bovendien accumuleert koper op de grond en is giftig voor micro -organismen en regenwormen. Dit conflicteert het concept van organische landbouw.
 Hoewel de CUSO4 Het wordt gebruikt in de organische landbouw kan schadelijk zijn voor aardwormen. Auteur: Patricia Maine Degrave. Bron: Pixabay.
Hoewel de CUSO4 Het wordt gebruikt in de organische landbouw kan schadelijk zijn voor aardwormen. Auteur: Patricia Maine Degrave. Bron: Pixabay. Op chemische reacties
De CUSO4 Watervrij dient als een katalysator voor verschillende reacties van carbonyl organische verbindingen met dioles of hun epoxiden, die dioxolanen of acetoniden vormen. Dankzij deze verbinding kunnen de reacties onder zachte omstandigheden worden gemaakt.
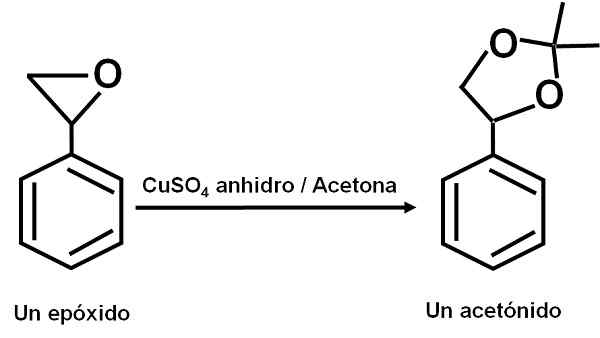 Voorbeeld van reactie waarin de CUSO4 watervrij fungeert als een katalysator. Auteur: Marilú Stea.
Voorbeeld van reactie waarin de CUSO4 watervrij fungeert als een katalysator. Auteur: Marilú Stea. Er is ook gemeld dat de katalytische werking het toelaat om secundaire, tertiaire, benzyl- en alilische alcoholen uit te drogen tot zijn overeenkomstige olefines. De reactie wordt op een heel eenvoudige manier gedaan.
Kan u van dienst zijn: anetolPure alcohol wordt samen met de CUSO verwarmd4 watervrij bij een temperatuur van 100-160 ° C gedurende een tijd van 0,5-1,5 uur. Aldus treedt alcohol en olefine uitdroging op, pure destilleert van het reactiemengsel.
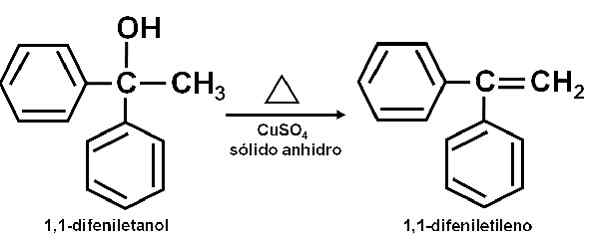 Uitdroging van een alcohol voor kopersulfaat (ii) watervrij. Auteur: Marilú Stea.
Uitdroging van een alcohol voor kopersulfaat (ii) watervrij. Auteur: Marilú Stea. Als uitdrogingsmiddel
Deze verbinding wordt in chemie -laboratoria gebruikt als droogmiddel. Het dient om organische vloeistoffen zoals oplosmiddelen uit te drogen. Absorberen water die de cuo pentahydraatverbinding vormt4 •5h2OF.
 Wanneer de CUSO4 Witte anhydro absorbeert water wordt de blauwe pentahydraatverbinding4.5h2OF. Kristal titan/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons.
Wanneer de CUSO4 Witte anhydro absorbeert water wordt de blauwe pentahydraatverbinding4.5h2OF. Kristal titan/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0). Bron: Wikimedia Commons. Om polymeren te verbeteren
De CUSO4 Anhydro is gebruikt om de eigenschappen van bepaalde polymeren te verbeteren en kunnen ze tegelijkertijd recyclebaar zijn.
Deeltjes van de acetonverbinding zijn bijvoorbeeld gemengd met acrylonitril-butadieenrubber in een speciale molen, in een poging Cuso-deeltjes te maken4 Heel klein zijn.
Kopersulfaat verbetert de polymeerunie die een mengsel vormen met hoge weerstand, hardheid en verrassende flexibiliteit.
In beëindigde therapeutische toepassingen
In het verleden werden kopersulfaatoplossingen voor maagwassen gebruikt toen iemand een witte fosforvergiftiging leed. De oplossing werd echter snel bewogen om koperen vergiftiging te voorkomen.
De oplossingen van deze verbinding werden ook samen met andere stoffen gebruikt voor actuele brandwonden in de huid door fosfor.
Soms dienden ze in bepaalde vormen van voeding.
Bepaalde lotions voor eczeem, Impetigo en Intertrigo bevatten Cuo4. Oplossingen werden gebruikt als samentrekkend in ooginfecties. Soms werden de kristallen direct aangebracht op brandwonden of zweren.
Al deze toepassingen worden niet langer gemaakt vanwege de toxiciteit die overtollige verbinding kan veroorzaken.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Kopersulfaat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Montag, J. et al. (2006). Een in vitro onderzoek naar Venturia inaequalis. J. Agrarisch. Food Chem. 2006, 54, 893-899. Link hersteld.Springer.com.
- Holloway, a.C. et al. (2011). Verbetering van antimicrobiële activiteiten van hele en ondervertekende witte thee door verslaving van koper (II) sulfaat en vitamine C tegen Staphylococcus aureus; Naar mechanistische benadering. BMC Complement Altern Med 11, 115 (2011). Opgehaald uit BMCComplementMedTherapies.biomedcentraal.com.
- Sanz, een. et al. (2018). Koperopname mechanisme van Thaliaanse Arabidopsis High -FFinity Copt Transporters. Protoplasma 256, 161-170 (2019). Link hersteld.Springer.com.
- Griminger, p. (1977). Effect van kopersulfaat op de productie van eieren en schaaldikte. Poultry Science 56: 359-351, 1977. Hersteld van academicus.Bol.com.
- Hanzlik, r.P. En leinwetter, m. (1978). Reactie van epoxiden en carbonylverbindingen gekatalyseerd door watervrij kopersulfaat. J. Borg. Chem., Vol.43, nee.3, 1978. Hersteld van pubs.ACS.borg.
- Okonkwo, een.C. et al. (1979). Koperen vereiste van babyvarkens gevoed gezuiverd dieet. The Journal of Nutrition, Volume 109, nummer 6, juni 1979, pagina's 939-948. Hersteld van academicus.Bol.com.
- Hoffman, r.V. et al. (1979). Watervrij koper (II) sulfaat: een efficiencencien. J. Borg. Chem., 1980, 45, 917-919. Hersteld van pubs.ACS.borg.
- Shao, c. et al. (2018). Verbeterde treksterkte van acrylonitril-butadieen rubber/watervrij kopersulfaatcomposieten bereid door coördinatie verknoping. Polym. Stier. 76, 1435-1452 (2019). Link hersteld.Springer.com.
- Betts, j.W. et al. (2018). Nieuwe antibacterials: alternatieven voor traditionele antibiotica. Koper. In de vooruitgang in de microbiële fysiologie. Hersteld van Scientedirect.com
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Google Sites. Maak watervrij kopersulfaat. In paradox thuischemie. Hersteld van sites.Google.com.
- « Regel T -functies, zodat het serveert, voorbeelden
- Constant (programmeren) concept, typen, voorbeelden »

