Calciumsulfaat (case4) chemische structuur, eigenschappen, gebruik
- 1254
- 13
- James Dach
Wat is calciumsulfaat?
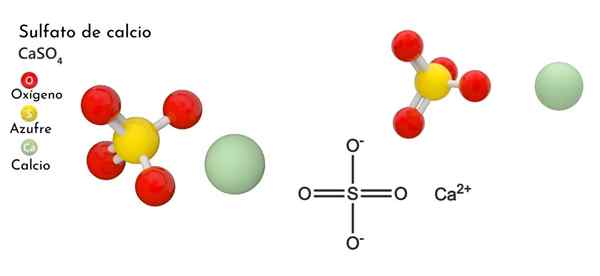
Hij calciumsulfaat Het is een ternair zout van calcium, alkalinother metaal (MR. Scholambara), zwavel en zuurstof. De chemische formule is case4, Wat dat betekent dat voor elk kation CA2+ Er is dus een anion42- Interactie hiermee. Vormt een verbinding met brede verdeling in de natuur.
De meest voorkomende vormen zijn het geval4· 2H2Of (het gips) en de watervrije vorm case4 (De anhydriet). Er is ook een derde vorm: het gips of gips van Parijs, geproduceerd door de verwarming van het gips (het hemidraat, geval4· 1/2H2OF).
Calciumsulfaat is een zeer nuttige verbinding in het werk van de mens, omdat het wordt gebruikt in talloze functies die wegenbouw, thuisverfeer en zelfs botherstel omvatten.
Chemische structuur van calciumsulfaat

In het bovenste beeld wordt de ortorrombische unitaire cel voor de zaak weergegeven4. Hier wordt aangenomen dat interacties puur elektrostatisch zijn; dat wil zeggen, dat cations2+ Ze trekken dus tetraëdrische anionen aan42-.
Maar de CA2+ Het is zeer vatbaar voor coördinaten, waardoor polyedrale structuren eromheen worden gevormd. Voor wat dit is? Naar de elektronische beschikbaarheid van calcium om elektronen van basis- of negatieve soorten te accepteren (zoals de atomen van O SO42-)).
Gezien het vorige punt, nu de ca ionen2+ Ze accepteren dative -links (geleverd door de O) en de eenheidscel wordt getransformeerd, zoals aangegeven door de lagere afbeelding:
Bijgevolg wordt polyhedro Cao gevormd8 (De groene sfeer van CA2+ omringd door acht rode bollen van of tetrahedra dus4 dichtbij). Calcium polyhedros en sulfaattetraëderra; Dit is de kristallijne structuur van de behuizing4 watervrij.
Het kan je van dienst zijn: Bipe Beraral: wat is, kenmerken, waar is het voorBovendien, wanneer de kristallen gehydrateerd zijn -vormen het di -gehydrateerde zout of het hemidraat (geval4· 1/2 H2O)- De structuur is vertraagd om watermoleculen op te nemen.
Deze moleculen kunnen worden afgewisseld en gecoördineerd met calcium; dat wil zeggen, ze vervangen een of twee sulfaatgroepen.
Aan de andere kant integreert niet al het water de CAO Polyhedron8. Sommigen vormen daarentegen waterstofbruggen met sulfaten. Deze dienen als een unie voor twee secties in zigzag, producten van de opstelling van ionen in het glas.
Calciumsulfaateigenschappen
 Calciumsulfaat uiterlijk
Calciumsulfaat uiterlijk Moleculaire formule
Case4 · NH2O.
Watervrij molecuulgewicht
136,134 g/mol.
Geur
Het is toilet.
Aspect
In het geval van anhydriet ziet het eruit als een wit ortorrombisch of monoklinisch vast poeder. De kristallen hebben een variabele kleur: ze kunnen wit zijn of met een blauwachtige, grijsachtige of roodachtige kleurstof; Het kan ook bakstenen rood zijn.
Dikte
2,96 gr/cm3 (watervrij vorm). 2.32 gr/cm3 (dihydraatvorm).
Smeltpunt
1450 ºC (2840 ºF). Kenmerkend voor de sterke elektrostatische interacties tussen de Divalent Ils Ca2+ En dus42-.
Oplosbaarheid
0,2-0,3 % in water bij 25 ° C. Het is weinig oplosbaar in water en onoplosbaar in ethanol.
Stabiliteit
Stabiel bij kamertemperatuur.
Gebruik van calciumsulfaat
In constructie en kunst
Het wordt gebruikt bij de uitwerking van het stucwerk om de muren van de huizen en andere constructies die bijdragen aan de verfraaiing van de huizen te frisareren. Bovendien worden mediamormen gemaakt op de daken en Windows -frames. Het gips bevindt zich ook in de haastige hemel.
Calciumsulfaat wordt gebruikt om het probleem op te lossen dat optreedt bij de hydratatie van beton, waardoor het samenwerkt bij de bouw van wegen, wegen, enz.
Het kan u van dienst zijn: elektrofiel: reacties, voorbeelden, elektrofyliteitMet het gips worden sculpturen uitgewerkt, vooral religieuze figuren, en op de begraafplaatsen worden ze in de grafstenen gebruikt.
Therapeutica
Dierenarts
Experimenteel zijn steriele calciumsulfaatstukken gebruikt in dierenarts om botdefecten of holtes te repareren, zoals die achtergelaten door wonden of tumoren.
Het gips of Parijse gips kan worden gebruikt om botdefecten te repareren vanwege hun unieke vermogen om osteogenese te stimuleren. X -Ray en Technecium Studies (TC99M) Medronaat.
Een botregeneratie is aangetoond bij zes honden in een periode van 4 tot 6 maanden. Calciumsulfaat begon in 1957 op dit gebied te worden gebruikt, in de vorm van Parijse gips tabletten, in staat om hondenbotten in te vullen.
Botvervanging van calciumsulfaat is vergelijkbaar met die waargenomen in het autogeen bot.
Ruheaimi (2001) paste calciumsulfaat toe in een nieuw vernietigd konijnenkaakbot, waarbij een toename van osteogenese en botcalcificatie werd waargenomen.
Geneesmiddel
Calciumsulfaat wordt in de geneeskunde gebruikt om de gewrichten te immobiliseren die dislocaties hebben geleden en in gebroken botten, naast gebruik als een excipiënt bij de uitwerking van tabletten.
odontologie
In de tandheelkunde wordt het gebruikt als basis voor het uitwerken van de tandheelkundige prothesen, in restauraties en indrukken van de tanden.
In voedselverwerking
Het wordt gebruikt als een stolling in de uitwerking van de tofu, een voedsel gemaakt met soja en van grote consumptie in oostelijke landen als een vleesvervanger. Bovendien is het gebruikt als een voedsel opnieuw bevestigend en bij de behandeling van bloem.
Kan u van dienst zijn: alotropieAls meststof en conditioner van gewasgrond
Het gips (geval4· 2H2O) Het werd sinds 18 uur gebruikt als meststoffen in Europa.
Calcium moet beschikbaar zijn voor plantenwortels voor voldoende aanbod. Vervolgens verbetert de toevoeging van calcium de tuinbouw- en pinda -gewassen (pinda's).
De rot van pinda -wortels geproduceerd door biologische pathogenen, evenals de apicale rot van watermeloen en tomaat, worden gedeeltelijk gecontroleerd met de agrarische gipsapplicaties.
Het gips helpt bij het verminderen van klei -dispersie, waardoor de vorming van korstjes op de grond wordt veroorzaakt. Door de op de grond gevormde korsten te verminderen, vergemakkelijkt het gips de uitgang van de zaailingen. Het verhoogt ook de binnenkomst van lucht en water tot de grond.
Het gips helpt de grond te verbeteren door de zuurgraad en toxiciteit van aluminium te verminderen, waardoor het gewas wordt aangepast voor natriumgronden.
Bij de productie van andere verbindingen
Calciumsulfaat reageert met ammoniumbicarbonaat om ammoniumsulfaat te vormen. Het is ook gebruikt in het productieproces van zwavelzuur.
Ashidro calciumsulfaat wordt gemengd met schalie of mager en, wanneer het mengsel wordt verwarmd, wordt zwaveltrioxide vrijgegeven. Zwaveloxide is een voorloper van zwavelzuur.