Aluminiumsulfaat (AL2 (SO4) 3)

- 1681
- 470
- Alton D'Amore
 Witte aluminiumsulfaatkristallen
Witte aluminiumsulfaatkristallen Wat is aluminiumsulfaat?
Hij aluminiumsulfaat Het is een anorganische formule aluminium zout naar de2(SW4))3, die meestal voorkomt als een witte vaste stof van glanzende kristallen. De kleur van de verbinding zal worden beïnvloed door de concentratie van ijzer en elke andere onzuiverheid. Er zijn twee hoofdtypen aluminiumsulfaat: A en B.
Het is een zeer oplosbaar zout zout, en in de natuur is het zeldzaam om het in zijn watervrije vorm te vinden. Het is meestal gehydrateerd in de vorm van octadecahydraat aluminiumsulfaat [tot2(SW4))3.18h2Of] of hexadecahydraat2(SW4))3.16h2OF].
Het kan ook dubbele zouten vormen met kalium, en met ammonium, verbindingen bekend als lichten. Gedeeltelijk kan dit te wijten zijn aan de affiniteit van water in de hydraten om andere ionen te behouden, naast aluminium.
Chemische structuur van aluminiumsulfaat
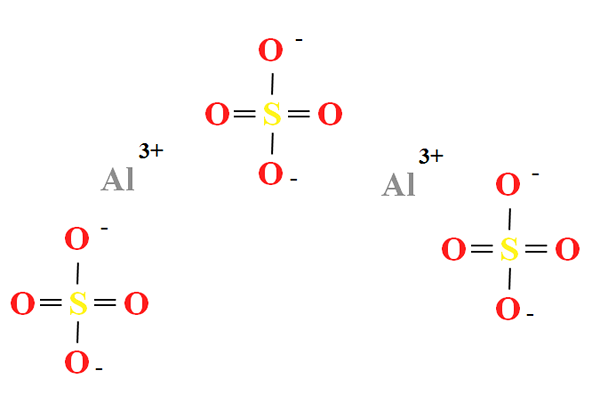 Chemische structuur van aluminiumsulfaat. Bron: Gabriel Bolívar
Chemische structuur van aluminiumsulfaat. Bron: Gabriel Bolívar Aluminiumsulfaat heeft een deel van twee kationen aan de3+ Voor elke drie anionen dus42- (superieure afbeelding), die direct in zijn chemische formule kan worden waargenomen voor de2(SW4))3.
Let daar op3+ Ze zijn grijsachtig, terwijl de SOS42- Ze zijn geel (voor het zwavelatoom) en rood (door zuurstofatomen).
De geïllustreerde structuur komt overeen met de watervrije vorm van Al2(SW4))3, Omdat geen watermolecuul interageert met de ionen. In zijn hydraten kan water echter worden aangetrokken tot de positieve centra van Al3+, of voor de negatieve tetrahedra van zo42- door waterstofbruggen (hah-o-so32-)).
De Al2(SW4))3∙ 18H2Of het bevat bijvoorbeeld 18 watermoleculen in zijn vaste structuur. Sommigen van hen kunnen in direct contact met hem zijn3+ of met de SOS42-. Met andere woorden: aluminiumsulfaat kan intern of extern coördinatiewater hebben.
Ook kan de structuur andere kationen huisvesten, zoals geloof3+, NA+, K+, enz. Maar hiervoor is de aanwezigheid van meer onder anionen nodig42-, Om de toename van positieve belastingen te neutraliseren als gevolg van metaalonzuiverheden.
Aluminiumsulfaat kan veel structuren hebben, hoewel de hydraten de neiging hebben om het monokliene kristallijne systeem aan te nemen.
Fysische en chemische eigenschappen
Aspect
Het wordt gepresenteerd als een vaste stof met flitsende witte kristallen, korrels of stof.
Molecuulgewicht
342.31 g/mol (watervrij).
Geur
Het is toilet.
Smaak
Zoete smaak, matig samentrekkend.
Smeltpunt
770º C Anhydra -vorm (86,5º C octadecahydraatvorm).
Oplosbaarheid in water
31.2 g/100 ml bij 0º C; 36,4 g/100 ml bij 20 ° C en 89 g/100 ml bij 100 ° C.
Dikte
2.67 tot 2,71 g/cm3.
Oplosbaarheid
Enigszins oplosbaar in ethylalcohol.
Dampdruk
In wezen nul.
Stabiliteit
Lucht in de lucht.
Ontleding
Wanneer verwarmd, ongeveer tot zijn smeltpunt, kan het worden verbroken door vooral zwaveloxide uit te zenden, een giftig gas.
Corrosiviteit
Aluminiumsulfaatoplossingen zijn corrosief voor aluminium. Ook kan de verbinding metalen corroderen in aanwezigheid van vocht.
Kan u van dienst zijn: gluconeogenesePka
3.3 tot 3.6. En de pH is 2,9 of meer in een waterige oplossing met 5%.
Aluminiumsulfaatgebruik
Waterstolling of flocculatie
- Indien gemengd met water (drinkbaar, geserveerd of afval), veroorzaakt aluminiumsulfaat aluminiumhydroxide, dat zich complex vormt met verbindingen en deeltjes in oplossing door de sedimentatie ervan te versnellen, wat in afwezigheid van behandeling met aluminiumsulfaat lang zou duren.
- Aluminiumsulfaat wordt ook gebruikt bij het reinigen van het zwembadwater, waardoor ze aantrekkelijker zijn om te gebruiken.
- Door het gebruik van aluminiumsulfaat, wordt een water zonder troebelheid en kleur bereikt, waardoor de poteerbaarheid wordt vergroot door waterreiniging te vergemakkelijken. Helaas kan deze zuiveringsmethode leiden tot een enigszins verhoogde aluminiumconcentratie in het water.
- Aluminium is een zeer giftig metaal dat zich ophoopt in de huid, hersenen en longen, wat ernstige aandoeningen veroorzaakt. Bovendien is het niet bekend welke functie vervult in levende wezens.
- De Europese Unie vereist dat de maximale toegestane limiet van aluminium in het water niet groter is dan 0,2 mg/l. Aan de andere kant eist het Amerikaanse Enviromental Protection Agency dat de maximale watervervuilingslimiet met aluminium niet groter is dan 0,05-0,2 mg/l.
- De behandeling van wateren die worden gebruikt of geserveerd met aluminiumsulfaat maakt de eliminatie of vermindering van fosfor erin, economisch.
Ik gebruik als inkt mordant en in de uitwerking van het papier
- Aluminiumsulfaat is gebruikt als een mordant van kleurstoffen of inkten, waardoor het textielmateriaal wordt gekeken. De bevestigingsactie is te wijten aan AL (OH)3, wiens gelatineuze consistentie samenwerkt met de adsorptie van kleurstoffen boven textiel.
- Hoewel het is gebruikt van ongeveer 2000 tot.C. Met het doel dat wordt beschreven, vereisen alleen organische kleurstoffen mordanten. Synthetische kleurstoffen daarentegen vereisen geen mordanten om hun functie te vervullen.
- Het is ontheemd door papierproductie, maar het wordt nog steeds gebruikt bij de uitwerking van papieren pulp. Verwijder uw onzuiverheden, evenals het is gebruikt om materialen te koppelen, belastingen te neutraliseren en colofonie te kalibreren.
Industrieel gebruik
- Het wordt gebruikt in de bouwsector om de betonnen omgeving te versnellen. Bovendien wordt het gebruikt bij de waterdichting van constructies.
- In de zeep- en vetindustrie wordt het gebruikt in de productie van glycerine.
- In de olie -industrie, voor de uitwerking van de synthetische katalysatoren die ze tijdens hun operatie gebruiken.
- Het wordt in de farmaceutische industrie gebruikt als samentrekkend bij het bereiden van geneesmiddelen en cosmetica.
- Grijpt in de uitwerking van kleurstoffen zoals karmijn. Het wordt ook gebruikt als een kleurstof bij de productie van synthetische rubber buttadieen stretus.
- In de suikerproductie -industrie wordt het gebruikt als een zuiveraar van het suikerrietje melasse.
- Het wordt gebruikt bij de productie van deodorants, omdat het de vernauwing van de kanaalkanalen van de zweetklieren veroorzaakt, waardoor de accumulatie van zweet wordt beperkt, een middel die nodig zijn voor de groei van de bacteriën die de slechte geur veroorzaakt.
- Het wordt gebruikt in lederen zonnebank, een proces dat nodig is voor gebruik. Bovendien wordt het gebruikt bij de productie van meststoffen.
- Het wordt gebruikt als een additief bij de uitwerking van schilderijen, lijmen en afdichtingsmiddelen, evenals reinigende en zorgzame producten van meubels.
Medicinaal en therapeutisch gebruik
- Aluminiumsulfaat is een immuunadjuvans. Daarom vervult het de functie van het verwerken van de antigenen zodanig dat wanneer ze worden vrijgegeven in hun plaats van actie, ze een grotere productie van antilichamen produceren voor de geïnoculeerde antigenen.
- Freund en BCG adjuvans, evenals de andere adjuvantia, waaronder endogenen zoals interleukines, zijn niet -specifiek voor antigenen, waardoor een toename van de straal van immuunactie mogelijk is. Dit heeft de uitwerking van vaccins tegen talloze ziekten mogelijk gemaakt.
- De coagulerende werking van aluminiumsulfaat heeft het mogelijk gemaakt om talloze virussen in behandeld water te elimineren, zoals de bèta, MS2, T4 en P1, onder andere. De resultaten geven aan dat de behandeling van water met aluminiumsulfaat een inactivering van dergelijke virussen produceert.
- Aluminiumsulfaat wordt gebruikt in een stang of als stof bij de behandeling van kleine oppervlakkige wonden of schaafwonden geproduceerd door scheren.
- Het wordt gebruikt bij de productie van aluminiumacetaat, verbinding gebruikt bij de behandeling van sommige ooraandoeningen. Het is ook gebruikt, zonder aanzienlijk succes, om de gevolgen van Bites van de brandmieren te verlichten.
- Aluminiumsulfaatoplossingen worden gebruikt, met een concentratie van 5% tot 10%, bij de lokale behandeling van zweren die controle over hun secreties mogelijk maken.
- De samentrekkende werking van aluminiumsulfaat samentrekt de oppervlaktelagen van de huid, coagulerende eiwitten en genezende wonden.
Andere gebruiken
- Aluminiumsulfaat helpt bij de controle van overmatige algengroei in vijvers, meren en waterstromen. Het wordt ook gebruikt bij de eliminatie van weekdieren, waaronder de Spaanse slak.
- Tuinders passen deze verbinding toe om alkalische bodems te verzuren. In contact met hun water ontleedt aluminiumsulfaat in aluminiumhydroxide en verdund zwavelzuur. Vervolgens neerslaat aluminiumhydroxide, het resterende zwavelzuur.
- De verzuring van bodems als gevolg van zwavelzuur wordt op een zeer creatieve manier gevisualiseerd, vanwege het bestaan van een plant genaamd Hydrangea, waarvan de bloemen blauw worden in aanwezigheid van een zure grond; dat wil zeggen, ze zijn gevoelig en reageren op pH -veranderingen.
- Aluminiumsulfaat komt tussenbeide in de uitwerking van een schuim om het vuur te bestrijden en te beheersen: het reageert met natriumbicarbonaat, waardoor de afgifte van CO wordt geproduceerd2. Dit gas blokkeert de toegang van de O2 naar de verbrandingslocatie van het materiaal, en bijgevolg de beëindiging van de brand die werd ontwikkeld.
Aluminiumsulfaatproductie
Aluminiumsulfaat wordt gesynthetiseerd door een verbinding te reageren die rijk is aan aluminium, zoals bauxietmineraal, met zwavelzuur bij hoge temperaturen. De volgende chemische vergelijking vertegenwoordigt de reactie:
Naar de2OF3 + H2SW4 -> Al2(SW4))3 + 3 H2OF
Aluminiumsulfaat kan zich ook vormen door een neutralisatiereactie tussen aluminiumhydroxide en zwavelzuur, volgens de volgende reactie:
2 tot (oh)3 + 3 H2SW4 + 12 H2Of -> tot2(SW4))3.18h2OF
Zwavelzuur reageert met aluminium om ammoniumsulfaat te vormen en de afgifte van waterstofmoleculen in de vorm van gas. De reactie is als volgt gepresteerd:
2 tot +3 H2SW4 -> Al2(SW4))3 + 3 H2
Soorten aluminiumsulfaat
Aluminiumsulfaat is ingedeeld in twee typen: Type A en Type B. In type A aluminiumsulfaat zijn vaste stoffen wit en hebben een ijzerconcentratie minder dan 0,5%.
In type B aluminiumsulfaat zijn vaste stoffen bruin en hebben een ijzerconcentratie minder dan 1,5%.
Er zijn aluminiumsulfaatproducerende industrieën die verschillende criteria hebben voor classificatie. Aldus rapporteert een industrie voor zijn bereiding van aluminiumsulfaattype tot een maximale concentratie van 0,1% ijzer als ijzeroxide.
Terwijl ze voor type B een maximale ijzerconcentratie van 0,35% aangeven.
Aluminiumsulfaattoxiciteit
- Aluminiumsulfaat is een verbinding die zijn giftige werking uitoefent door contact met zijn stof, waardoor huidirritatie wordt veroorzaakt, en in gevallen waarin contact frequent is, dermatitis.
- In de ogen veroorzaakt het sterke irritatie, zelfs het produceren van permanente verwondingen.
- De inademing ervan produceert irritatie van de neus en keel, die hoest en carraspera kan veroorzaken.
- De inname veroorzaakt maagirritatie, misselijkheid en braken.
- Er zijn toxische effecten die hoewel ze niet rechtstreeks te wijten zijn aan aluminiumsulfaat, ze indirect zijn voor hun gebruik. Dit is het geval van bepaalde toxische effecten van aluminium, veroorzaakt door het gebruik van aluminiumsulfaat in waterzuivering.
- Patiënten die chronisch worden gediiseerd met behulp van zouten bereid in gezuiverd water door het gebruik van aluminiumsulfaat, ervaren zeer ernstige gezondheidsstoornissen. Onder deze aandoeningen noemen we bloedarmoede, dialyse dementie en een toename van botziekten.
Referenties
- Wikipedia. (2018). Aluminiumsulfaat. Genomen van: in.Wikipedia.borg
- Industriële aris. Aluminium sulfaattype A en B. Genomen uit: aris.com.pe
- Christopher Boyd. (9 juni 2014). Top industrieel gebruik voor aluminiumsulfaat. Genomen uit: chemservice.com
- Pubchem. (2018). Aluminiumsulfaat watervrij. Genomen van: PubChem.NCBI.NLM.NIH.Gov
- Chemical Andesia. (20 augustus 2009). Aluminium sulfaatveiligheidsblad. [PDF]. Genomen van: Andesia.com
- Chemisch boek. (2017). Aluminiumsulfaat. Genomen uit: ChemicalBook.com

