Sublimatieconcept, proces en voorbeelden
- 4931
- 593
- James Dach
De sublimatie Het is een thermodynamisch proces waarbij een verandering van endotherme toestand rechtstreeks optreedt van een vaste stof naar een gas, zonder de voorafgaande vorming van de vloeistof. Een uitstekend voorbeeld van dit proces is dat van droog ijs; Wanneer het wordt blootgesteld aan de zon of ondergedompeld in een vloeistof, gaat deze rechtstreeks van de vaste naar gasvormige toestand.
Het gedrag van de vaste stof onder normale omstandigheden is het opwarmen en ontstaan van een eerste druppel, waarbij meer vaste deeltjes oplossen tot het volledig smelt. Ondertussen is er in sublimatie gesproken over een "bel", van een progressieve stoom zonder het oppervlak te bevochtigen dat aanraakt, maar onmiddellijk afgezet of kristalliseert.
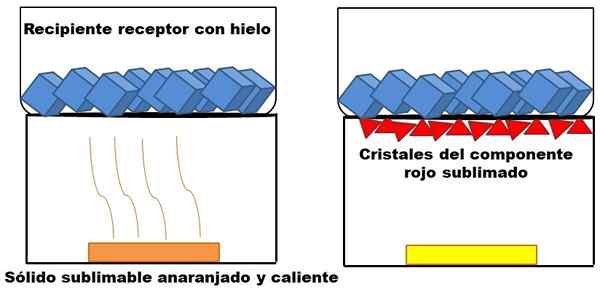
 Voorbeeld van sublimatie van een hypothetische oranje vaste stof. Bron: Gabriel Bolívar.
Voorbeeld van sublimatie van een hypothetische oranje vaste stof. Bron: Gabriel Bolívar. Wat wordt beschreven in de topparagraaf wordt weergegeven in het superieure beeld. Stel dat een oranje vast mengsel (links), dat zijn energie begint te verhogen door de temperatuur te verhogen. De sublimale rode component, en vervolgens op de bodem van de ontvangende container afgezet, waarvan de temperatuur lager is als gevolg van ijsblokjes in zijn inhoud.
Rode driehoeken of kristallen worden afgezet dankzij het koude oppervlak van deze container (rechts), die de temperatuur absorbeert; En zelfs als het niet wordt getoond, moet de grootte van de ijsblokjes afnemen als gevolg van warmteabsorptie. De resterende vaste stof heeft een niet -publieke gele component onder procesomstandigheden.
[TOC]
Sublimatieconcept
Proces
Er is al gezegd dat sublimatie een endotherme toestandsverandering is, omdat er om het hiervoor warmteabsorptie moet zijn. Als de vaste stof warmte absorbeert, zal de energie toenemen, zodat de deeltjes ook trillen met grotere frequenties.
Wanneer deze trillingen erg sterk worden, beïnvloeden ze uiteindelijk intermoleculaire interacties (geen covalente bindingen); En bijgevolg zullen de deeltjes vroeg of laat meer afstanden van elkaar nemen, totdat ze erin slagen om te stromen en vrijer door de ruimte van de ruimte te bewegen.
Kan u van dienst zijn: diagonale regelIn sommige vaste stoffen zijn de trillingen zo sterk, dat sommige deeltjes buiten de structuur worden "geactiveerd" in plaats van agglomeratie in mobiele clusters die een druppel definiëren. Deze deeltjes ontsnappen en integreren de eerste "bel", die liever de eerste dampen van de gesublimeerde vaste stof zou vormen.
Het wordt dan niet gesproken over een smeltpunt, maar over een sublimatie. Hoewel beide afhankelijk zijn van de regerende druk op de vaste stof, is het punt van sublimatie meer; Daarom varieert de temperatuur aanzienlijk bij drukveranderingen (zoals het geval is met het kookpunt).
Van de vaste structuur tot gasstoornis
In sublimatie wordt ook gezegd dat er een toename van systeemtropie is. De energietoestanden van de deeltjes gaan van beperkt worden door hun vaste posities in de vaste structuur, naar homogeniseren in hun wispelturige en chaotische richtingen in de gasvormige toestand, meer uniform, waar ze eindelijk een gemiddelde kinetische energie verwerven.
Fasediagram en drievoudige punt
Het sublimatiepunt hangt af van de druk; Omdat anders de vaste deeltjes warmte zouden absorberen om niet op de ruimte te worden afgevuurd buiten de vaste stof, maar om druppels te vormen. Het zou niet worden gesublimeerd, maar zou smelten of smelten, zoals het meest gebruikelijk is.
Hoe groter de externe druk, hoe minder waarschijnlijk de sublimatie zal zijn, omdat de vaste stof verplicht is.
Maar welke vaste stoffen zijn sublimabel en welke niet? Het antwoord ligt in uw P vs T -fasendiagrammen, zoals hieronder getoond:
Kan u van dienst zijn: neon: geschiedenis, eigenschappen, structuur, risico's, gebruik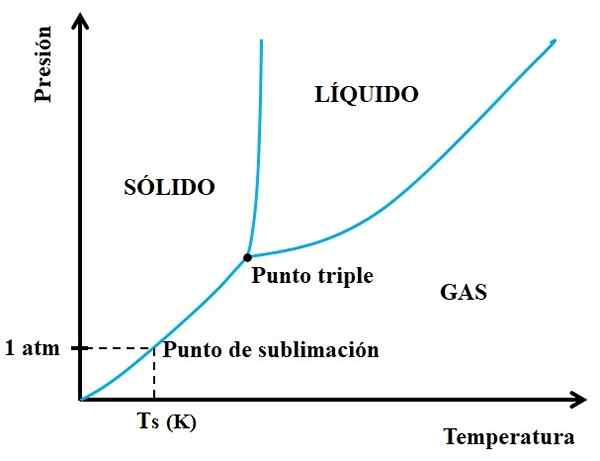 Fasediagram voor een hypothetische stof. Bron: Gabriel Bolívar.
Fasediagram voor een hypothetische stof. Bron: Gabriel Bolívar. Je moet eerst naar het drievoudige punt kijken en het onderste stuk reizen: degene die de vaste en gasvormige toestanden scheidt. Merk op dat in het vaste gebied een afname van de druk moet zijn, zodat sublimatie optreedt (niet noodzakelijkerwijs 1 atmosferische druk). Een 1 atm, de hypothetische stof zal sublim zullen zijn bij een TS -temperatuur uitgedrukt in K.
Hoe langer en langer de sectie of de curve onder het drievoudige punt, hoe groter de capaciteit van de vaste stof naar sublim bij verschillende temperaturen; Maar als het ver onder 1 atm is, is het nodig met hoge gaten om sublimatie te bereiken, zodat de druk wordt verminderd (bijvoorbeeld 0,0001 atm).
Voorwaarden
Als het drievoudige punt duizenden keren lager is dan de atmosferische druk, zal de vaste stof nooit sublim zijn of zelfs ultra -leven toepassen (om nog maar te zwijgen van de gevoeligheid ervan om te ontbinden door de werking van warmte).
Als dit niet het geval is, worden de sublimaties door middel van matig gedaan en de vaste stof in te dienen zodat hun deeltjes gemakkelijker ontsnappen, zonder de noodzaak om zoveel warmte te absorberen.
Sublimatie wordt erg belangrijk wanneer ze vooral vaste stoffen zijn met hoge stoomdruk; dat wil zeggen de druk binnen, weerspiegeling van de efficiëntie van zijn interacties. Hoe groter zijn stoomdruk, hoe geurder het is, en ook sublimeerbaarder.
Voorbeelden
Vaste zuivering
Het beeld van de oranje vaste stof en de sublimeerbare roodachtige component is een voorbeeld van wat sublimatie vertegenwoordigt met betrekking tot vaste zuivering. Rode driehoeken kunnen zo vaak als noodzakelijk worden hersteld totdat een hoge zuiverheid is gegarandeerd.
Kan u van dienst zijn: laboratorium spatelDeze techniek wordt voornamelijk gebruikt met geurige vaste stoffen. Bijvoorbeeld: kamfer, cafeïne, benzoine en mentol.
Onder andere vaste stoffen die sublimatie kunnen onder de wederzijds kunnen zijn: jodium, ijs (op grote hoogten), theobromine (chocolade), saccharine, morfine en andere geneesmiddelen, stikstofbases en antraceen.
Kristallen synthese
Terugkerend naar rode driehoeken biedt sublimatie een alternatief voor conventionele kristallisatie; Kristallen zullen niet langer worden gesynthetiseerd uit een oplossing, maar door middelen.
Laten we zeggen, als ze rode vierkanten hebben, zal de groei van de kristallen deze geometrie behouden en niet driehoekig worden. De rode vierkanten zullen geleidelijk groeien als sublimatie plaatsvindt. Het is echter een operationeel en moleculair complex complex, waarbij veel betrokken variabelen worden gezien.
Voorbeelden van gesynthetiseerde kristallen via sublimatie zijn: siliciumcarbide (sic), grafiet, arseen, selenium, fosfor, aluminium nitruro (ALN), cadmiumsulfide (cds), zink seleniuro (Znse), Mercury (Hgi (Hgi)2), grafeen, onder andere.
Merk op dat ze echt twee gecompenseerde fenomenen zijn: progressieve sublimatie en afzetting (of omgekeerde sublimatie); De stoom emigreert van de vaste naar koudere gebieden of oppervlakken, om uiteindelijk in de vorm van kristallen te deponeren.
Thema's van belangstelling
Voorbeelden van sublimatie.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2019). Sublimatie (faseovergang). Opgehaald uit: in.Wikipedia.borg
- Jones, Andrew Zimmerman. (27 januari 2019). Sublimatie. Hersteld van: Thoughtco.com
- Sheila Morrissey. (2019). Wat is sublimatie in de chemie? - Definitie, proces en examens. Studie. Hersteld van: studie.com
- Elsevier B.V. (2019). Sublimatiemethode. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- « Tropisch bos subcaducifolio kenmerken, flora, fauna
- Geïntefineerde integrale eigenschappen, toepassingen, berekening (voorbeelden) »

