Oplossing
- 1783
- 248
- Cecil Graham
Wat is de solvatie?
De Oplossing Het is de fysische en chemische vereniging tussen deeltjes opgeloste stof en oplosmiddel in een oplossing. Het verschilt van het concept van oplosbaarheid in het feit dat er geen thermodynamische balans is tussen een vaste stof en zijn opgeloste deeltjes.
Deze unie is verantwoordelijk voor de ontbonden vaste stoffen "verdwijnen" met het oog op de toeschouwers; Wanneer in werkelijkheid de deeltjes erg klein worden en worden "gewikkeld" door oplosmiddelmoleculen, waardoor ze onmogelijk zijn om ze te observeren.

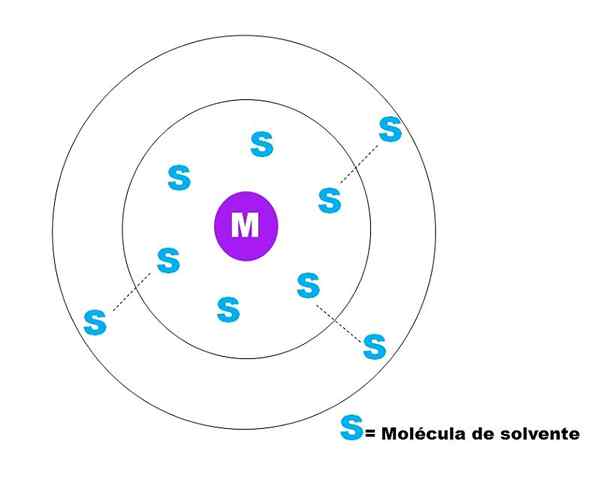
In de bovenste afbeelding wordt een zeer algemene schets van de oplossing van een deeltjes M weergegeven. M kan in orde zijn (m+) of een molecuul; En S is het oplosmiddelmolecuul, dat elke verbinding in vloeibare toestand kan zijn (hoewel het ook gas kan zijn).
Merk op dat M wordt omringd door zes s s, die bestaat uit wat bekend staat Primaire solvatie -sfeer. Andere M -moleculen op een hogere afstand interageren door van der Waals -krachten met de eerste, die een secundaire oplossingssfeer vormen, enzovoort totdat een bestelling duidelijk is.
Solvatieproces
 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Moleculair, hoe is het solvatieproces? De bovenste afbeelding vat de nodige stappen samen.
De oplosmiddelmoleculen, blauw, worden aanvankelijk bevolen om met elkaar te communiceren (S-S); En de deeltjes (ionen of moleculen) van opgeloste stof, paars, doen hetzelfde met sterke of zwakke M-M-interacties.
Om de solvatie op te treden, moeten zowel oplosmiddel als opgeloste opgeloste stof uitbreiden (tweede zwarte pijl) om opgeloste interacties van opgeloste oplosmiddelen (M-S) mogelijk te maken.
Dit impliceert noodzakelijkerwijs een afname van interacties op het gebied van opgeloste oplosmiddel en oplosmiddel; afnemen die energie vereist, en daarom is deze eerste stap endotherm.
Zodra de opgeloste stof en het oplosmiddel moleculair zijn uitgebreid, mengen zowel plaatsen als wisselkoers in de ruimte uit. Elke paarse cirkel van het tweede beeld kan worden vergeleken met die van de eerste afbeelding.
Kan u van dienst zijn: calcium: eigenschappen, structuur, verkrijgen, gebruikEen verandering in de mate van ordening van de deeltjes kan in de afbeelding worden gedetailleerd; in het begin besteld en rommelig aan het einde. Als gevolg hiervan is de laatste stap exotherme, omdat de vorming van de nieuwe interacties alle deeltjes van de oplossing stabiliseert.
Energieaspecten
Achter het solvatieproces zijn er veel energieaspecten waarmee rekening moet worden gehouden. Ten eerste: de interacties S-S-S, M-M en M-S.
Wanneer de M-S-interacties, dat wil zeggen tussen de opgeloste stof en het oplosmiddel, ze veel superieur (sterk en stabiel) zijn in vergelijking met die van de individuele componenten, is er sprake van een exotherme oplossingsproces; En daarom wordt energie vrijgegeven aan de omgeving, die kan worden geverifieerd door de temperatuurstijging met een thermometer te meten.
Als integendeel de interacties M-M en S-S sterker zijn dan de M-S, dan om te 'uitbreiden' meer energie nodig hebben dan degene die ze verdienen zodra de solvatie culmineert.
Er wordt dan gesproken over een endotherme oplossingsproces. Als dit geval is er een afname van de temperatuur, of wat hetzelfde is, de omgeving koel.
Er zijn twee fundamentele factoren die regeren of een opgeloste stof oplost in een oplosmiddel. De eerste is de verandering van oplossing van oplossing (ΔHDis), Zoals uitgelegd, en de tweede is de verandering van entropie (δs) tussen de opgeloste stof en de opgeloste opgeloste stof. Over het algemeen wordt AS geassocieerd met de hierboven genoemde toename van de aandoening.
Intermoleculaire interacties
Er werd vermeld dat de solvatie het resultaat is van de fysische en chemische unie tussen de opgeloste stof en het oplosmiddel; Hoe zijn deze interacties of vakbonden echter precies?
Als de opgeloste stof een ion is, m+, De zogenaamde ion-dipolo-interacties worden geproduceerd (m+-S); En als het een molecuul is, zijn er dipool-dipolo-interacties of Londense dispersiekrachten.
Kan u van dienst zijn: cyclohexaan: structuur, gebruik, conformatiesAls je het hebt over dipolo-dipolo-interacties, wordt gezegd dat er een permanent dipoolmoment is in m en s. Aldus interageert het gebied dat rijk is aan elektronen Δ- van M met het slechte gebied van elektron Δ+ van s. Het resultaat van al deze interacties is de vorming van verschillende sferen van solvatie rond M.
Bovendien zijn er andere soorten interacties: de coördinatief. Hier vormen de moleculen van S -coördinatiekoppelingen (of dative) met M, die verschillende geometrieën vormen.
Een fundamentele regel om de affiniteit tussen de opgeloste stof en het oplosmiddel te onthouden en te voorspellen is: gelijk oplost gelijk. Daarom lossen polaire stoffen met groot gemak op in oplosmiddelen even polair; en apolaire stoffen, los op in apolaire oplosmiddelen.
Verschillen tussen solvatie en hydratatie
 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Hoe verschilt de oplossing van hydratatie? De twee identieke processen, behalve omdat de s s, van het eerste beeld, worden vervangen door die van het water, h-o-h.
In de superieure afbeelding zie je een kation m+ omgeven door zes H -moleculen2OF. Merk op dat zuurstof (rood) atomen worden gericht op een positieve belasting, omdat het het meest elektronegatief is en daarom de grootste negatieve dichtheid heeft A-.
Achter de eerste sfeer van hydratatie worden andere watermoleculen gegroepeerd door waterstofbruggen (OH2-Oh2)). Dit zijn interacties van het ion-dipolo-type. Watermoleculen kunnen echter ook coördinatiebindingen vormen met het positieve centrum, vooral als het metallic is.
Dus de beroemde aquocomplejos, m (oh2))N. Als n = 6 in het beeld zijn de zes moleculen gericht op M in een octaëder van coördinatie (de interne sfeer van hydratatie). Afhankelijk van de grootte van M+, De omvang van zijn belasting, en de elektronische beschikbaarheid, zei dat bol kleiner of groter kan zijn.
Kan u van dienst zijn: chroomoxide (iii): structuur, nomenclatuur, eigenschappen, gebruikWater is misschien wel het meest verrassende oplosmiddel van allemaal: het lost een onmetelijke hoeveelheid opgeloste stoffen op, het is een oplosmiddel te polair en heeft een abnormaal hoge diëlektrische constante (78.5 k).
Voorbeelden van oplossing
Hieronder staan drie voorbeelden van solvatie in water.
Calciumchloride
Bij het oplossen van calciumchloride in water wordt warmte vrijgegeven wanneer de ca -kationen worden opgelost2+ en cl anions-. De CA2+ Het wordt omgeven door een aantal watermoleculen gelijk aan of groter dan zes (CA2+-Oh2)).
Ook de CL- Het wordt omgeven door waterstofatomen, het A+ -gebied van het water (CL--H2OF). De vrijgegeven warmte kan worden gebruikt voor het smelten van ijsmassa.
Ureum
In het geval van ureum is het een organisch molecuul met H -structuur2N-co-nh2. Bij het oplossen, H Moleculen2O Vorm waterstofbruggen met de twee aminggroepen (-nh2-Oh2) en met de carbonylgroep (c = o- h2OF). Deze interacties zijn verantwoordelijk voor hun grote oplosbaarheid in water.
Ook de oplossing is endotherm, dat wil zeggen, het koelt de watercontainer waar deze wordt toegevoegd.
Ammonium nitraat
Ammoniumnitraat is, net als ureum, een opgeloste stof die de oplossing koelt na de oplossing van zijn ionen. De NH4+ Solvata vergelijkbaar met CA2+, Hoewel waarschijnlijk omdat het tetraëdrische geometrie is, bezit minder H -moleculen2Of om hem heen; En nee3- Solvata op dezelfde manier als cl anions- (Oh2-OF2No- h2OF).
Referenties
- Whitten, Davis, Peck & Stanley. Scheikunde. (8e ed.)). Cengage leren.
- Belford r. (S.F.)). Solvatieprocessen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Guppy Surf. (S.F.)). Het proces van solvatie. Opgehaald uit: Surfgupy.com

