Chemische oplossingen
- 3367
- 821
- Ernesto McKenzie
We leggen uit welke chemische oplossingen, hun kenmerken, de soorten die bestaan en verschillende voorbeelden geven
 Een chemische stof is een homogeen mengsel tussen twee stoffen
Een chemische stof is een homogeen mengsel tussen twee stoffen Wat zijn chemische oplossingen?
De Chemische oplossingen Het zijn homogene mengsels tussen een oplosmiddel en een of meer opgeloste stoffen. De eenvoudigste oplossingen worden gevormd door een enkele opgeloste stof en een oplosmiddel, zoals wanneer we suiker in water oplossen, maar er zijn oplossingen die zeer complex kunnen worden met honderden opgeloste stoffen.
De meest voorkomende oplossingen bevinden zich in vloeibare toestand en in de meeste gevallen is het oplosmiddel water. Om deze reden wordt het water meestal "het universele oplosmiddel" genoemd. Maar de oplossingen zijn niet beperkt tot vloeistoffen, omdat er oplossingen zijn in een gasvormige en vaste toestand.
De opgeloste stof is ook te vinden in verschillende staten. Vloeistofoplossingen met vaste opgeloste stoffen (zoals zout), vloeistoffen (zoals alcohol) of gasvormige (zoals koolstofgas in frisdranken) kunnen bijvoorbeeld vaste oplossingen krijgen).
Hoe u de opgeloste stof en het oplosmiddel herkent?
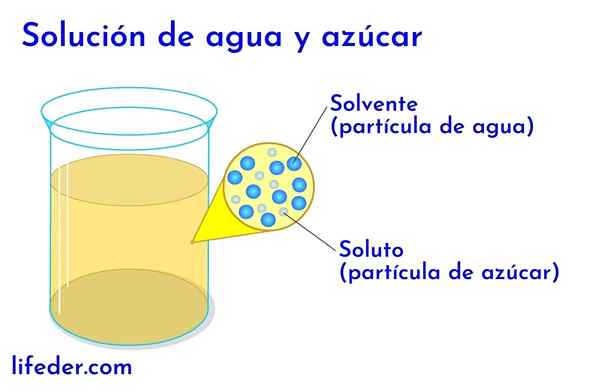
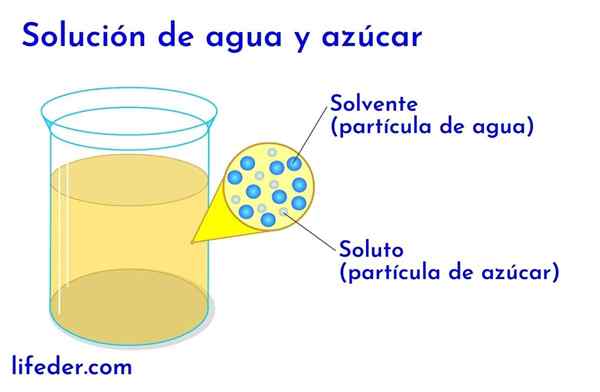 Opgeloste stof en oplosmiddel in water met suiker
Opgeloste stof en oplosmiddel in water met suiker In elke oplossing waarin water is, wordt dit beschouwd als het oplosmiddel. In alle andere gevallen komt het oplosmiddel overeen met de component die in grotere hoeveelheid of in een groter verhouding staat en bijna altijd een vloeistof is. De andere componenten die in de oplossing aanwezig zijn, worden beschouwd als opgeloste stoffen.
Laten we eens kijken naar twee voorbeelden:
- In een oplossing van water en suiker is water het oplosmiddel en suiker de opgeloste stof.
- De isopropylalcohol die we in de apotheek kopen, is een oplossing gevormd door water en alcohol. In deze oplossing is het oplosmiddel water ondanks dat het in een kleinere verhouding is dan alcohol.
Kenmerken en eigenschappen van chemische oplossingen
Het zijn homogene mengsels
De oplossingen zijn mengsels waarin de oplosmiddel opgeloste stof niet kan worden onderscheiden, hetzij tot het blote oog of met het gebruik van een vergrootglas of een microscoop.
Ze hebben een uniforme compositie
Dit betekent dat elk deel van een oplossing altijd dezelfde componenten (opgeloste stof en oplosmiddel) tot dezelfde concentratie zal hebben.
Kan u dienen: cadmium (CD): geschiedenis, eigenschappen, structuur, gebruikZe worden gekenmerkt door hun concentratie
Concentratie is een van de belangrijkste kenmerken van een oplossing, omdat het veel van zijn eigenschappen bepaalt.
Ze zijn doorzichtig (transparant)
Vloeibare oplossingen moeten doorzichtig zijn, dat wil zeggen dat het licht ze moet kunnen oversteken zonder zich te verspreiden.
Ze zijn stabiel
Een oplossing waarin de opgeloste stof en het oplosmiddel niet op elkaar reageren, zal voor onbepaalde tijd stabiel zijn. Dit betekent dat het in de loop van de tijd geen verandering zal ondergaan, zolang de samenstelling constant blijft (het oplosmiddel verdampt bijvoorbeeld niet).
De fysische en chemische eigenschappen verschillen van die van het oplosmiddel
De fysische en chemische eigenschappen van de oplosmiddel veranderen bij het mengen met de opgeloste stof. Oplossingen hebben bijvoorbeeld een groter kookpunt, een lager smeltpunt en hebben ook een hoge osmotische druk in vergelijking met puur oplosmiddel.
Ze kunnen worden gescheiden door enkele fysische en chemische processen
Oplossingen kunnen niet worden gescheiden door filtratie, centrifugatie of decantatie. Ze kunnen alleen worden gescheiden door fysische of chemische methoden zoals kristallisatie, destillatie, verdamping, omgekeerde osmose en chromatografie, onder andere.
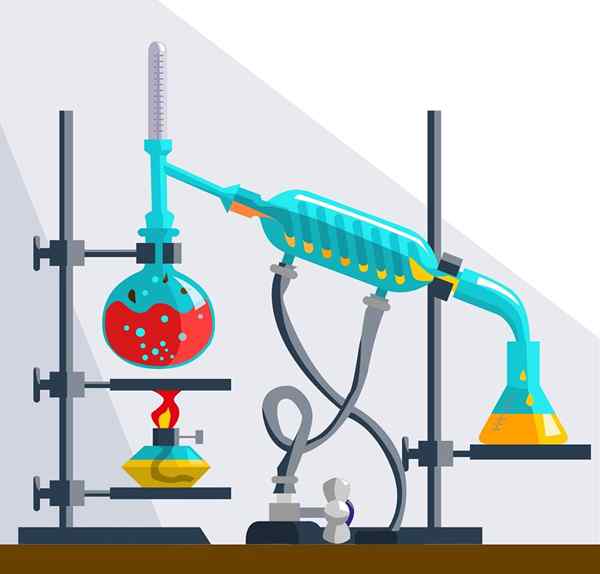 Destillatie -instrumenten
Destillatie -instrumenten Soorten chemische oplossingen
Chemische oplossingen kunnen worden geclassificeerd volgens hun concentratie, volgens hun fysieke toestand en volgens de aard van het oplosmiddel:
Volgens uw concentratie
- Onverzadigde oplossingen: Zij zijn die waarin de opgeloste stof de maximale concentratie in het oplosmiddel nog niet heeft bereikt. Daarom kan meer opgeloste stof worden opgelost om een meer geconcentreerde oplossing te bereiden.
- Verzadigde oplossingen: Het zijn oplossingen waarin het oplosmiddel niet langer opgeloste opgeloste stof kan oplossen. In deze gevallen is er altijd een deel van de opgeloste stof zonder op te lossen. Als we bijvoorbeeld veel zout toevoegen aan een glas met water, zal een deel van dit zout niet oplossen en op de bodem van het glas blijven.
- Opgebouwde oplossingen: Dit zijn oplossingen waarin er meer opgeloste opgeloste stof is dan het oplosmiddel. Dit kan worden bereikt door een verzadigde oplossing te verwarmen om nog meer opgeloste stof op te lossen, en dan langzaam afkoelen tot de begintemperatuur. Deze oplossingen zijn onstabiel, omdat elke verstoring zoals trillingen of een klein stofdeeltje op het oppervlak de scheiding van overtollige opgeloste stof kan veroorzaken.
Volgens uw fysieke conditie
- Vloeibare oplossingen: Ze zijn de meest voorkomende. In dit type oplossingen is het oplosmiddel een vloeistof (zoals water, alcohol, olie, enz.) Maar de opgeloste stof is te vinden in elke toestand (vaste, vloeistof of gas). Enkele voorbeelden van vloeibare oplossingen zijn zout water, wijn en frisdranken.
- Solid oplossingen: In deze gevallen zijn zowel het oplosmiddel als de opgeloste stof in vaste toestand. De meest voorkomende voorbeelden van dit type oplossingen zijn metaallegeringen zoals brons, staal en messing, maar er zijn ook andere voorbeelden zoals glas.
- Gasvormige oplossingen: Zoals de naam al aangeeft, zijn het homogene mengsels waarin alle componenten zich in een gasvormige toestand bevinden.
Volgens het oplosmiddel
- Waterige oplossingen: Als het oplosmiddel in een oplossing water is, wordt gezegd dat het een waterige oplossing is. Dit zijn de meest voorkomende oplossingen die in het dagelijkse leven kunnen worden gevonden.
- Alcoholische oplossingen: Het meest voorkomende oplosmiddel, na water, is alcohol. Een van de meest voorkomende alcoholen zijn methanol, ethanol en isopropylalcohol.
- Oplossingen in andere organische oplosmiddelen: Er zijn veel andere organische verbindingen die worden gebruikt als oplosmiddelen. Deze omvatten enkele alkanen, de meeste ethers, vloeibare ketonen en andere.
Voorbeelden van chemische oplossingen
Limonade
Het is een waterige oplossing gevormd door water als een oplosmiddel en citroensap en suikerachtige opgeloste stof.
Zeewater
Zeewater of zout water is een waterige oplossing bestaande uit water en een mengsel van zouten. Onder deze zouten is degene die het grootste deel is natriumchloride (NaCl) bekend als gemeenschappelijk tafelzout.
Kan u van dienst zijn: kwikoxide (hg2o)Geconcentreerde siroop
Dit is een waterige oplossing die bijna verzadigd is met suikerwater.
Koolzuurhoudend water
Carbonerd water, ook bekend als frisdrank, is een waterige oplossing van gasvormige koolstofdioxide (CO2) In water.
Lucht
Lucht is een gasvormige oplossing waarbij stikstof kan worden beschouwd als oplosmiddel en zuurstof en andere gassen als opgeloste stof.
Verduidelijkte boter
Door de boter te smelten en al het schuim te verwijderen, wordt een transparante gele oplossing genaamd geklaarde boter verkregen. Dit is een oplossing waarin zowel het oplosmiddel als de opgeloste stoffen dik zijn.
Gekleurd glas
Kleurglas zijn solid -state oplossingen, waarin het oplosmiddel gesmolten silica is en opgeloste stoffen zijn andere mineralen die glas zijn karakteristieke kleur bieden.
Koffie
Dit is een complexe waterige oplossing die veel opgeloste stoffen bevat (waaronder de cafeïne) die de drank zijn karakteristieke aroma en smaak geven.
Het staal
Staal is een legering of vaste oplossing gevormd door metaalijzer en grafietkoolstof.
Bloed plasma
Bloedplasma is een oplossing die wordt verkregen na het centrifugeren van het bloed om alle cellen en andere gesuspendeerde vaste stoffen te verwijderen. Dit is een vrij geconcentreerde waterige oplossing die honderden opgeloste stoffen bevat, waaronder koolhydraten, aminozuren, oplosbare eiwitten en elektrolyten, onder andere.
Referenties
- Chang, R. en Goldsby, K. (2014). Scheikunde. 11e ed. New York: McGraw-Hill Education.
- Oplossing (25 januari 2021). In Wikipedia.borg.
- Bruin, t. L., Lemay, e. (2018). Chemie: de centrale wetenschap. 14e editie. Pearson.
- Krestonosich, s., en anderen. (1992). Oplossingen. Redactionele miró.
- Vidal, J. NAAR. (Editor) (1997). Interactieve mentor - Student thematische encyclopedie. Ocean Editorial. Barcelona.

