Soluties van schokdemper

- 604
- 106
- Cecil Graham
We leggen uit wat de dempende oplossingen, hun eigenschappen, componenten, types zijn en geven verschillende voorbeelden
 De schokabsorberende oplossingen reguleren de pH rond een specifieke waarde
De schokabsorberende oplossingen reguleren de pH rond een specifieke waarde Wat zijn dempingoplossingen?
De Soluties van schokdemper, Ook buffers, pH- of buffersregelaars genoemd, zijn waterige oplossingen gevormd door zwak zuur en de conjugaatbasis of een zwakke basis en het geconjugeerde zuur.
Ze worden schokdemperoplossingen genoemd, omdat ze de mogelijkheid hebben om de pH -verandering te dempen na de toevoeging van zuren of basen in kleine hoeveelheden, zelfs als het sterke zuren of basen is.
De schokdemperoplossingen zijn erg nuttig, omdat ze de pH constant laten zijn. Er zijn veel chemische reacties die een specifieke en constante pH nodig hebben om goed te functioneren.
Eigenschappen van de Morpainary Solutions
Het zijn waterige oplossingen
Zowel het pH -concept als de pH -schaal zijn alleen zinvol in waterige oplossingen, dus alle buffers of dempingsoplossingen worden in water bereid.
De werking is gebaseerd op het zuur-base evenwicht en de principes van Le Chatlier
Buffers zijn gebaseerd op omkeerbare dissociatiereacties met zuur/base die in evenwicht zijn. Door sterke zuren of basen aan de omgeving toe te voegen, wordt deze balans verstoord, dus het systeem reageert om de verstoring tegen te gaan, volgens de principes van Le Catelier. Dit is hoe buffers erin slagen om de grote veranderingen in de pH te dempen.
Uw pH wordt gemakkelijk berekend met Henderson-Haselbalch-vergelijking
Ongeacht welk type schokdemperoplossing, de pH ervan, zowel voor als na het toevoegen van kleine hoeveelheden sterke zuren of basen, kan het worden berekend door middel van de Henderson-Hohaselbalch-vergelijking:
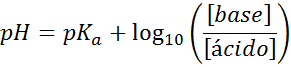
Waarbij [base] verwijst naar de molaire concentratie van de basis (of het zout van de conjugaatbasis) en [zuur] verwijst naar de molaire concentratie van het zuur (of van het zout van het geconjugeerde zuur).
Kan u van dienst zijn: elastische materialenZe kunnen zowel zuren als basen gedeeltelijk neutraliseren
De dempingsoplossingen bestaan uit een basisstof en een zure substantie, die respectievelijk bases en zuren kan neutraliseren. Om deze reden kunnen ze de pH dempen na de toevoeging van zowel sterke zuren als sterke basen.
De werking ervan hangt af van de temperatuur
De pH van een bufferoplossing hangt af van de zuurgraad of basisconstante van de zuur of zwakke basis die deze bevat. Deze constante hangt af van de temperatuur, dus de werking van deze oplossingen hangt ook af van de temperatuur.
Hoe meer geconcentreerd, hoe groter het vermogen om de pH te dempen of te reguleren
Het dempingscapaciteit hangt af van de totale concentratie van de oplossing is groter dan de uiteindelijke concentratie van het zuur of de sterke basis die wordt toegevoegd. Om deze reden, hoe groter de totale concentratie van de bufferoplossing, hoe groter het vermogen om zuren of sterke basen te dempen.
Componenten van een demping- of bufferoplossing
Chemisch gezien worden dempende oplossingen gevormd door slechts twee componenten. Deze componenten kunnen een zwak zuur zijn dat wordt gemengd met een zout van de conjugaatbasis of een zwakke basis gemengd met een zout van zijn geconjugeerde zuur.
Er zijn twee verschillende manieren om deze componenten in dezelfde oplossing te verkrijgen, zoals we hieronder zullen zien:
1. Voorbereiding van buffers die oplossingen van zijn componenten mengen
Dit is de meest directe manier om een bufferoplossing voor te bereiden. Om dit te doen, worden afzonderlijke oplossingen van zwak zuur (bijvoorbeeld azijnzuur) en een geconjugeerde basezout (bijvoorbeeld natriumacetaat) bereid afzonderlijke oplossingen bereid). Dan mengen beide oplossingen geleidelijk tot de gewenste pH.
Het kan u van dienst zijn: Ion ammonium (NH4+): formule, eigenschappen en gebruik
- Oplossingen worden beetje bij beetje gemengd tot de gewenste pH
2. Bereiding van buffers door gedeeltelijke neutralisatie van een oplossing van een zwak zuur
In dit geval wordt een zwakke zuuroplossing bereid met de gewenste totale concentratie, en vervolgens wordt natrium- of kaliumhydroxide beetje bij beetje toegevoegd totdat het de gewenste pH bereikt.
Soorten bufferoplossingen
De schokdemperoplossingen kunnen worden geclassificeerd volgens de soorten componenten die ze bezitten of volgens hun laatste pH.
Volgens de soorten componenten:
- Zwakke en geconjugeerde basisbuffer: In deze gevallen hangt de pH af van PKnaar van zwak zuur.
- Zwakke basisbuffer en geconjugeerd zuur: In deze gevallen hangt pH af van PKB zwak.
- Polyprotische zuurzoutenbuffer: In sommige gevallen zijn zowel de rol van zwak zuur als de conjugaatbasis beide zouten uit de gedeeltelijke neutralisatie van een zuur dat verschillende protonen heeft, zoals zwavelzuur of fosfor.
Volgens de laatste pH:
Afhankelijk van de zuurgraad of basisconstante, kan een bufferoplossing pH reguleren rond verschillende pH -bereiken, wat leidt tot drie soorten buffers:
- Zure buffers: Zijn die die pH reguleren rond waarden lager dan 7. Ze worden bereid met zwakke zuren waarvan de PKnaar minder dan 7 zijn of met zwakke bases waarvan de PKB zijn groter dan 7.
- Neutrale buffers: Zijn degenen die pH reguleren rond 7. Ze bestaan meestal uit zwakke zuren of bases met een PKnaar of een PKB Bijna 7.
- Alkalische buffers: Zijn degenen die pH reguleren rond waarden groter dan 7. Ze worden bereid met zwakke zuren waarvan de PKnaar groter zijn dan 7 of met zwakke bases waarvan de PKB is minder dan 7.
Voorbeelden van buffers of dempende oplossingen
Azijnzuurbuffer/natriumacetaat
Dit is een buffer van een zwak zuur (azijnzuur) en een zout van de conjugaatbasis (natriumacetaat). De betrokken balans en zijn evenwichtsconstante zijn:
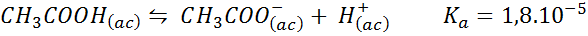
Deze buffer reguleert de pH rond 4.74.
Ammoniakbuffer/ammoniumchloride
Dit is een zwakke basisbuffer (ammoniak of ammoniumhydroxide) en een zout van zijn geconjugeerde zuur (ammoniumchloride). De betrokken balans en zijn evenwichtsconstante zijn:
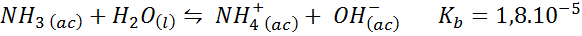
Dit is een alkalische buffer die de pH rondom reguleert 9.26.
Bisulfaat/sulfaatbuffer
In dit geval speelt het bisulfaat -ion het papier van zwak zuur waarvan de conjugaatbasis het sulfaation is. Het evenwicht is:
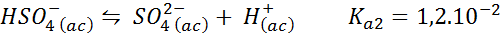
Dit is een oplossing met zure schokken die de pH reguleert 3.05.
Koolzuur/bicarbonaatbuffer
Dit is een van de belangrijkste pH -regulatiesystemen in ons bloed. De betrokken reactie is: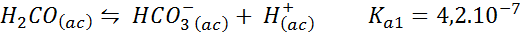
Deze buffer reguleert de pH rond 6.38.
Dihydrogen buffer fosfaat/waterstoffosfaat
Dit is een van de meest gebruikte pH -regulatiesystemen in de biologie en biochemie, omdat het mogelijk maakt om de pH zeer dicht bij de fysiologische pH te reguleren waaraan de meeste chemische reacties in cellen optreden. De reactie is:
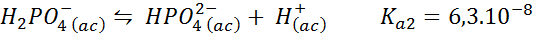
Deze buffer reguleert de pH rond 7.20.

