Selenium geschiedenis, eigenschappen, structuur, verkrijgen, gebruik

- 2377
- 314
- Glen Armstrong
Hij selenium Het is een niet -metalen chemische stof die tot groep 16 van de periodiek systeem behoort en wordt weergegeven door het symbool is. Dit element heeft tussenliggende eigenschappen tussen zwavel en Telurio, die lid zijn van dezelfde groep.
Het selenium werd in 1817 ontdekt door Jöhs J. Berzelius en John G. Gahn, die het pyriet verdampte, observeerde een rood residu (lager beeld). Eerst verwarden ze hem met de Telurio, maar realiseerden zich toen dat ze geconfronteerd werden met een nieuw element.
 Een fles met amorf rood selenium, het bekendste alotrope voor dit element. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Een fles met amorf rood selenium, het bekendste alotrope voor dit element. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Berzelius noemde het nieuwe element als Selenium, gebaseerd op de naam "Selene", wat "maangodin" betekent. Selenium is een essentieel spoor voor planten en dieren, hoewel het in hoge concentraties een giftig element is.
Het selenium heeft drie belangrijkste allotrope vormen: rood, zwart en grijs. De laatste heeft de eigenschap om zijn elektrische geleidbaarheid te wijzigen op basis van de intensiteit van het licht dat het uitstraalt (fotoconductor), dus het heeft veel toepassingen gehad.
Het selenium is wijd verspreid in de korst van de aarde, maar de mineralen die het bevatten zijn niet overvloedig, dus er is geen mijnbouwbuitering van selenium.
Het wordt voornamelijk verkregen als een secundair product van het raffinageproces door koperelektrolyse. Selenium accumuleert in het slijm dat zich op de anode van elektrolysecellen bevindt.
Mensen hebben ongeveer 25 seleenoproteïnen, waarvan sommige een antioxiderende actie vervullen en de generatie van vrije radicalen beheersen. Er zijn ook seleniumaminozuren, zoals selenomectionine en selenocysteïne.
[TOC]
Geschiedenis
Eerste observatie
De alchemist Arnold van Villanova heeft mogelijk het selenium waargenomen in 1230. Dit werd gevormd in de geneeskunde in de Sorbonne van Parijs en was zelfs de arts van paus Clemente v.
Villanova in zijn boek Rosarium Philosophorum Beschrijf een rode zwavel of "zwavel -reboule" die in een oven was gebleven na het verdampen van de zwavel. Deze rode zwavel had een alotrope van het selenium kunnen zijn.
Ontdekking
In 1817 ontdekten Jöhs Jakob Berzelius en John Gottlieb Gahn selenium in een chemische fabriek voor de productie van zwavelzuur, nabij Gripsholm, Zweden, Zweden. De grondstof voor de uitwerking van het zuur was pyriet, dat uit een Falun -mijn werd geëxtraheerd.
Berzelius werd getroffen door het bestaan van een rood residu dat in de loodcontainer bleef nadat de zwavel was verbrand.
Ook merkten Berzelius en Gahn op dat het rode residu een sterke geur van kruidige radijs had, vergelijkbaar met die gepresenteerd door de Telurio. Reden waarom, hij schreef aan zijn vriend Marect dat ze geloofden dat de waargenomen aanbetaling een Telurio -compound was.
Blelius bleef echter het afgezette materiaal analyseren door het pyriet te verbranden en heroverwogen dat Telurio niet in de Falun was gevonden. Concludeerde in februari 1818 dat hij een nieuw element had ontdekt.
Oorsprong van uw naam
Berzelius wees erop dat het nieuwe element een combinatie was van zwavel en Telurio, en dat de gelijkenis van de Telurio met het nieuwe element hem de gelegenheid had gegeven om de nieuwe Selenium -substantie te noemen.
Berzelius legde uit dat "tellus" godin van de aarde betekent. Martin Klaport plaatste in 1799 deze naam aan Telurio en schreef: “Geen element wordt alleen op die manier genoemd. Het moest gedaan worden!".
Vanwege de gelijkenis van de Telurio met de nieuwe stof, noemde Berzelius het met het woord selenium, afgeleid van het Griekse woord "selene", wat "godin van de maan" betekent.
Ontwikkeling van uw toepassingen
In 1873 ontdekte Willoughby Smith dat de door het selenium gepresenteerde elektrische geleidbaarheid afhankelijk was van het licht dat het straalde. Met deze eigenschap kon Selenium talloze toepassingen hebben.
Alexander Graham Bell in 1979 gebruikte Selenium in zijn borstophone. Selenium produceert een elektrische stroom die evenredig is aan de intensiteit van het licht dat het verlicht, met behulp van lichtmeters, beveiligingsmechanismen voor het openen en sluiten van deuren, enz.
Het gebruik van seleniumrichters in elektronica begon vanaf de jaren dertig, met tal van commerciële toepassingen. In de jaren zeventig werd hij vervangen in de gelijkrichters voor silicium.
In 1957 werd ontdekt dat selenium een essentieel element was voor de levensduur van zoogdieren, omdat het aanwezig was in enzymen die beschermen tegen reactieve zuurstof en vrije radicalen. Bovendien werd het bestaan van aminozuren zoals selenometionine ontdekt.
Fysische en chemische eigenschappen
Verschijning
Er zijn verschillende alotropen voor selenium, hun fysieke uiterlijk varieert. Het wordt meestal gepresenteerd als een roodachtige vaste stof in de vorm van stof.
Standaard atoomgewicht
78.971 u
Atoomnummer (z)
3. 4
Smeltpunt
221 ºC
Kookpunt
685 ºC
Dikte
Seleniumdichtheid varieert afhankelijk van welke alotrope of polymorf wordt overwogen. Sommige van de vastberaden dichtheden bij kamertemperatuur zijn:
Grijs: 4.819 g/cm3
Alfa: 4,39 g/cm3
Glasachtig: 4,28 g/cm3
Vloeibare toestand (smeltpunt): 3,99 g/cm3
Fusiewarmte
Grijs: 6,69 kJ/mol
Verdampingswarmte
95.48 kJ/mol
Molaire caloriecapaciteit
25,363 J/(mol · k)
Oxidatienummers
Het selenium kan worden gekoppeld in zijn verbindingen die de volgende getallen of oxidatietoestanden manifesteren: -2, -1, +1, +2, +3, +4, +5, +6. Onder hen zijn de belangrijkste -2 (2-), +4 (ik weet het4+) en +6 (ik weet het6+)).
Kan u van dienst zijn: eenvoudige microscoopBijvoorbeeld in SEO2 Het selenium heeft +4 oxidatienummer; dat wil zeggen, het bestaan van het kation wordt verondersteld4+ (HIJ4+OF22-)). Vergelijkbaar met SEO3 Het selenium heeft +6 oxidatienummer (i6+OF32-)).
In waterstof seleniuro, h2SE, het selenium heeft een oxidatienummer van -2; dat is opnieuw het bestaan van het ion of anion wordt verondersteld2- (H2+HIJ2-)). Dit komt omdat selenium meer elektronegatief is dan waterstof.
Elektronegativiteit
2.55 op de Pauling -schaal.
Ionisatieenergie
-Eerst: 941 kJ/mol.
-Ten tweede: 2.045 kJ/mol.
-Derde: 2.973.7 kJ/mol.
Magnetische volgorde
Diamagnetisch.
Hardheid
2.0 op de mohs -schaal.
Isotopen
Er zijn vijf natuurlijke en stabiele isotopen van selenium, die hieronder worden weergegeven met hun respectieve overvloed:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Stoffen
 Zwarte fles bedekt met een dunne film van seleniumgrijs. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Zwarte fles bedekt met een dunne film van seleniumgrijs. Bron: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Het selenium bereid in chemische reacties is een bakstenen rood amorf poeder, dat wanneer de glasachtige zwarte vorm is gebaseerd, vergelijkbaar met Rosario -accounts (superieur beeld). Zwart selenium is een bros en glanzende solid.
Bovendien is zwart selenium enigszins oplosbaar in koolstofsulfide. Wanneer deze oplossing wordt verwarmd op 180 ºC, gaat het grijze selenium neer, het zijn meest stabiele en dichte alotrope.
Grijs selenium is resistent tegen oxidatie en is inert voor de werking van niet -oxiderende zuren. De belangrijkste eigenschap van dit selenium is de fotoconductiviteit. Verlicht worden verhoogt zijn elektrische geleidbaarheid met een factor 10 tot 15 keer.
Reactiviteit
Het selenium in zijn verbindingen bestaat in de oxidatietoestanden -2, +4 en +6. Vertoont een duidelijke neiging om zuren te vormen in hogere oxidatietoestanden. De verbindingen met het selenium met de oxidatietoestand -2 worden seleniuros genoemd (2-)).
Waterstofreactie
Selenium reageert met waterstof om waterstof seleniuro te vormen (h2Se), een kleurloos, brandbaar en stinkend gas.
Zuurstofreactie
De selenium brandt door een blauwe vlam uit te zenden en seleniumdioxide te vormen:
HIJ8 (s) + 8 o2 => 8 SEO2 (S)
Seleniumoxide is een polymeer, witte en vaste stof. De hydratatie produceert seleneus zuur (h2SEO3)). Selenium vormt ook seleniumtrioxide (SEO3), Analoog aan zwavel (dus3)).
Reactie met halogenen
Het selenium reageert met fluoride om de selenium hexafluoruro te vormen:
HIJ8 (s) +24 f2 (g) => 8 SEF6 (L)
Het selenium reageert met chloor en broom om respectievelijk dichloride en dysilenium dibromure te vormen:
HIJ8 (S) +4 Cl2 => 4 SE2Klet2
HIJ8 (s) +4 br2 => 4 SE2BR2
Selenium kan ook SEF vormen4 en SECL4.
Aan de andere kant vormt het selenium verbindingen waarin een seleniumatoom zich aansluit bij een van halogeen en een andere van zuurstof. Een belangrijk voorbeeld is selenium oxychloride (SEO2Klet2), Met selenium in oxidatie +6, een extreem krachtig oplosmiddel.
Reactie met metalen
Selenium reageert met metalen om aluminium, cadmium en natriumseleniuros te vormen. De chemische stof van hieronder komt overeen met de vorming van de aluminium seleniuro:
3 SE8 + 16 al => 8 tot2HIJ3
Selenitas
Het selenium vormt zouten bekend als Selenitas; Bijvoorbeeld: zilver seleniet (Ag2SEO3) en natriumseleniet (NA2SEO3)). Deze naam is in een literaire context gebruikt om te verwijzen naar inwoners van de maan: de Selenitas.
Zuren
Het belangrijkste seleniumzuur is zeehondenzuur (h2SEO4)). Het is zo sterk als zwavelzuur en is gemakkelijker verminderd.
Elektronische structuur en configuratie
- Het selenium en zijn links
Het selenium heeft zes elektronen van Valencia, daarom bevindt het zich in groep 16, hetzelfde als zuurstof en zwavel. Deze zes elektronen zijn te vinden in 4s en 4p orbitalen, volgens hun elektronische configuratie:
[AR] 3D10 4S2 4P4
Daarom vormen, net als zwavel, twee covalente bindingen om zijn octet van Valencia te voltooien; Hoewel het de beschikbaarheid van zijn 4D -orbitalen heeft om meer dan twee atomen te koppelen. Aldus naderen drie seleniumatomen en vormen twee covalente bindingen: se-se-se.
Selenium met zijn grotere atoommassa heeft een natuurlijke neiging om structuren te vormen die worden beheerst door covalente bindingen; in plaats van te worden gerangschikt als diatomaire moleculen2, SE = SE, analoog aan O2, O = O.
- Ringen of ketens
Onder de moleculaire structuren die door seleniumatomen zijn aangenomen, kunnen er twee in algemene termen worden vermeld: ringen of ketens. Merk op dat in het hypothetische geval van de SE3, Atomen zijn nog steeds vereist door de uiteinden; Daarom moeten ze achtereenvolgens linken naar andere atomen, totdat de ketting in een ring kan worden gesloten.
De meest voorkomende ringen zijn die van acht leden of seleniumatomen:8 (Een Selenite -kroon). Waarom acht? Omdat hoe kleiner de ring, zal de spanning lijden; Dat wil zeggen dat de hoeken van hun banden afwijken van de natuurlijke waarden die zijn vastgesteld door hun SP -hybridisaties3 (vergelijkbaar als bij cycloalcanos).
Kan u van dienst zijn: Pascal SyringeEr zijn acht atomen, de scheiding tussen de SE-atomen is voldoende om hun banden "ontspannen" te zijn en niet "gevouwen"; Hoewel de hoek van zijn links 105.7 is en niet 109.5. Aan de andere kant kunnen er kleinere ringen zijn: i6 En7.
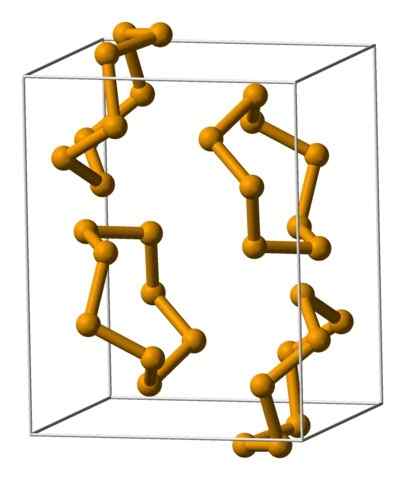 Selenium Analeres -eenheden vertegenwoordigd met een model van bollen en balken. Bron: Benjah-bmm27 [Public Domain].
Selenium Analeres -eenheden vertegenwoordigd met een model van bollen en balken. Bron: Benjah-bmm27 [Public Domain]. In het bovenste beeld worden de analeres -eenheden getoond8. Let op de gelijkenis die ze hebben met de zwavelkronen; Alleen ze zijn groter en zwaar.
Naast de ringen kunnen seleniumatomen ook worden gerangschikt in spiraalvormige ketens (denk aan slakkenrappen):
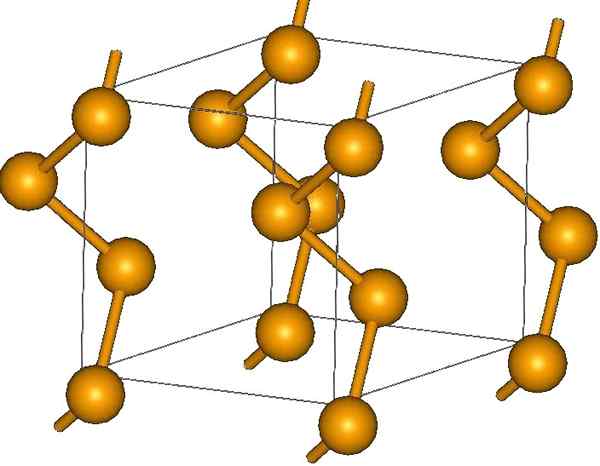 Spiraalvormige seleniumketens. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Spiraalvormige seleniumketens. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Aan de uiteinden kunnen er dubbele terminale links zijn (-SE = SE), of ringen zijn8.
- Alotropen
Rekening houdend met dat er selenium spiraalvormige ringen of ketens kunnen zijn, en dat hun dimensies ook kunnen variëren, afhankelijk van het aantal atomen dat ze bevatten, is het duidelijk dat er meer dan één alotropisch is voor dit element; Dit zijn pure selenium vaste stoffen maar met verschillende moleculaire structuren.
Rood selenium
Onder de meest prominente alotropen van selenium hebben we rood, dat kan worden gepresenteerd als een amorf stof, of als monoklien en polymorfe kristallen (zie afbeelding van de ringen zijn8)).
In het amorfe rode selenium zijn structuren wanordelijk, zonder duidelijke patronen; In de lens stellen de ringen een monokliene structuur vast. Het kristallijne rode selenium is polymorf, met drie fasen: α, β en γ, die verschillen in hun dichtheden.
Zwart selenium
De structuur van het zwarte selenium bestaat ook uit ringen; Maar geen acht leden, maar nog veel meer, er zijn ringen van duizend atomen (1000)). Er wordt dan gezegd dat zijn structuur complex is en bestaat uit polymere ringen; sommige groter of klein dan andere.
Wanneer er polymere ringen van verschillende maten zijn, is het moeilijk om te wachten op een structurele volgorde; Dus het zwarte selenium is ook amorf, maar in tegenstelling tot het hierboven genoemde roodachtige stof, heeft het glazige contexturen, hoewel het bros is.
Grijs selenium
En ten slotte, van de eenvoudigste alotropen van het selenium is grijs, wat opvalt boven andere door de meest stabiele te zijn onder normale omstandigheden, en ook een metaalachtig uiterlijk te hebben.
Hun kristallen kunnen zeshoekig of trigonaal zijn, opgericht door de dispersiekrachten van Londen tussen hun polymere spiraalvormige ketens (superieur beeld). De hoek van zijn links is 130,1 º, wat een positieve afwijking van de tetraëdrische omgevingen aangeeft (met hoeken van 109,5 °).
Dat is de reden waarom selenium spiraalvormige ketens de indruk wekken "open" te zijn. Bij wijze van elucubratie worden de atomen in deze structuur geconfronteerd, dus in theorie moet er een grotere overlap van hun orbitalen zijn om rijbanden te creëren.
Warmte met de toename van moleculaire trillingen schaadt deze banden wanneer de ketens wanordelijk zijn; Terwijl de energie van een foton direct invloed heeft op elektronen, hen opwindend en hun transacties bevordert. Uit deze visie is het "gemakkelijk" om je fotoconductiviteit voor seleniumgrijs voor te stellen.
Waar is en productie
Hoewel het op grote schaal is verdeeld, is Selenium een zeldzaam element. Het is in native staat geassocieerd met zwavel en mineralen zoals Eucairita (Cuagse), clousdalita (PBSE), Naumanite (Ag Ag2SE) en Crookesite [(Cutiag)2HIJ].
Selenium wordt gevonden als een onzuiverheid die zwavel vervangt in een klein deel van metalen zwavelachtige mineralen; zoals koper, lood, zilver, etc.
Er zijn bodems waarin selenium bestaat in de oplosbare vorm van selenaat. Deze worden gedragen door de wateren van de regen naar de rivieren en vanaf daar naar de oceaan.
Sommige planten kunnen selenium absorberen en concentreren. Een kopje noten in Brazilië bevat bijvoorbeeld 544 µg selenium, een bedrag die gelijk is aan 777% van de hoeveelheid selenium die dagelijks wordt aanbevolen.
In levende wezens wordt selenium gevonden in sommige aminozuren, zoals: selenometionine, selenocysteïne en methylselenocysteïne. Selenocysteïne en seleniet worden gereduceerd tot waterstof seleniuro.
Koperen elektrolyse
Er is geen mijnbouwbuitering van selenium. Het grootste deel wordt verkregen als een secundair product van het raffinageproces door koperelektrolyse, in het slib dat zich ophoopt in de anode.
De eerste stap bestaat uit de productie van seleniumdioxide. Hiervoor wordt anodisch slank met natriumcarbonaat behandeld om zijn oxidatie te produceren. Dan wordt het seleniumoxide toegevoegd water en wordt het aangezuurd om het seleniczuur te vormen.
Ten slotte is het het selenale zuur met zwaveldioxide om de reductie te produceren en het elementaire selenium te verkrijgen.
In een andere methode in het mengsel van slib en modder gevormd bij de productie van zwavelzuur wordt een onzuiver rood selenium verkregen dat oplost in zwavelzuur.
Samenvoeringszuur en selleenzuur worden vervolgens gevormd. Dit selenious zuur krijgt dezelfde behandeling als de vorige methode.
Chloor kan ook worden gebruikt, die werkt op metalen seleniuros om vluchtige selenium gechloreerde verbindingen te produceren; zoals: ik weet het2Klet2, Slokje4, Slokje2 en seocl2.
Kan u van dienst zijn: chemisch niveauDeze verbindingen, in een proces dat in het water wordt uitgevoerd, worden seleneus zuur, dat wordt behandeld met zwaveldioxide om selenium af te geven.
Biologisch papier
Tekort
Selenium is een essentieel spoor voor planten en dieren, wiens tekort bij mensen ernstige aandoeningen heeft veroorzaakt, zoals de ziekte van Keshan; Een ziekte die wordt gekenmerkt door myocardiale schade.
Bovendien wordt seleniumtekort geassocieerd met mannelijke onvruchtbaarheid en kan het een rol spelen bij de ziekte van Kashin-Beck, een soort artrose. Evenzo is een seleniumtekort waargenomen bij reumatoïde artritis.
Enzymatische cofactor
Selenium is een component van enzymen met antioxiderende werking, zoals GlutationA -peroxidase en tioresodoxine -reductase die werken in de eliminatie van stoffen met reactieve zuurstof.
Bovendien is selenium een cofactor van desiodinases van schildklierhormonen. Deze enzymen zijn belangrijk bij het reguleren van het functioneren van schildklierhormonen.
Het gebruik van selenium is geïndiceerd bij de behandeling van de ziekte van Hasimoto, een auto -immuunziekte met de vorming van antilichamen tegen schildkliercellen.
Selenium is ook gebruikt om de toxische effecten van kwik te verminderen, omdat sommige van zijn acties worden uitgeoefend op seleniumafhankelijke antioxiderende enzymen.
Eiwitten en aminozuren
De man heeft ongeveer 25 seleenoproteïnen die een antioxiderende werking uitoefenen voor bescherming tegen oxidatieve stress, geïnitieerd door een overmaat reactieve zuurstofspecies (ROS) en reactieve stikstofsoorten (NI).
De aanwezigheid van aminozuren selenomethytheocine en selenocysteïne bij mensen is gedetecteerd. Selenomectionine wordt gebruikt als voedingssupplement bij de behandeling van seleniumtekortstaten.
Risico's
Een hoge seleniumlichaamconcentratie kan talloze schadelijke effecten hebben op de gezondheid, beginnend met bros haar en brosse nagels, tot huiduitslag, warmte, huidoedeem en ernstige pijn.
Bij het omgaan met Selenium in contact met de ogen, kunnen mensen enthousiasme, irritatie en traan uiten. Ondertussen kan langdurige blootstelling aan een rook met een hoog seleniumgehalte, longoedeem, knoflook adem en bronchitis veroorzaken.
Bovendien kan de persoon pneumonitis, misselijkheid, koude rillingen, koorts, keelpijn, diarree en hepatomegalie ervaren.
Selenium kan interageren met andere medicijnen en voedingssupplementen, zoals antacida, antineoplastische geneesmiddelen, corticosteroïden, niacine en pillen voor anticonceptie.
Selenium is geassocieerd met een verhoogd risico op het aansluiten van huidkanker. In een studie van het National Cancer Institute werd erop gewezen dat mannen met een hoge seleniumlichaamconcentratie twee keer zo waarschijnlijk een kans hadden om te lijden aan agressieve prostaatkanker.
Een studie geeft aan dat de dagelijkse inname van 200 µg selenium de mogelijkheid verhoogt om een diabetes type II te ontwikkelen.
Toepassingen
Cosmetica
Seleniumsulfide wordt gebruikt bij de behandeling van seborroe, evenals vet of roos.
Artsen
Het wordt gebruikt als een alternatief medicijn bij de behandeling van de ziekte van Hasimoto, een auto -immuun schildklierziekte.
Selenium vermindert de toxiciteit van kwik, waarvan een van zijn giftige activiteiten wordt uitgeoefend op deoxidant -enzymen, die het selenium als een cofactor gebruiken.
Mangaan elektrolyse
Het gebruik van seleniumoxide in mangaan -elektrolyse verlaagt de kosten van de techniek aanzienlijk, omdat het elektrische consumptie afneemt.
Pigment
Selenium wordt gebruikt als een pigment in schilderijen, kunststoffen, keramiek en glas. Afhankelijk van het selenium dat de kleur van het glas wordt gebruikt, varieert van een diep rood tot licht oranje.
Fotogeleidend
Vanwege de eigenschap van het grijze selenium van het veranderen van zijn elektrische geleidbaarheid, afhankelijk van de intensiteit van het licht dat het uitstraalt, is het selenium gebruikt in fotokopieën, fotokipers, fotometers en zonnecellen.
Het gebruik van selenium in fotokopieën was een van de belangrijkste seleniumtoepassingen; Maar het uiterlijk van organische fotoconductoren heeft het gebruik ervan verminderd.
Kristallen
Het selenium wordt gebruikt voor de verkleuring van het glas, als gevolg van de aanwezigheid van ijzer dat een groene of gele kleuring produceert. Bovendien maakt het een rode kleur van glas mogelijk, afhankelijk van het gebruik dat u het wilt geven.
Vulkanisatie
Dietenio diëtenium wordt gebruikt als een vulkanisatiemiddel van rubberproducten.
Legeringen
Selenium wordt gebruikt in combinatie met de bismut in het messing, om lood te vervangen; Zeer giftig element dat het gebruik ervan heeft verminderd vanwege de aanbevelingen van gezondheidsinstanties.
Selenium wordt toegevoegd aan lage concentraties aan stalen en koperlegeringen om het gebruiksgemak van deze metalen te verbeteren.
Gelijkrichters
Selenium gelijkrichters begonnen te worden gebruikt in 1933 tot de jaren 1970, toen ze werden vervangen door silicium door lage kosten en hogere kwaliteit.
Referenties
- Royal Australian Chemical Institute. (2011). Selenium. [PDF]. Hersteld van: raci.borg.Au
- Wikipedia. (2019). Selenium. Opgehaald uit: in.Wikipedia.borg
- Sato Kentaro. (S.F.)). Nieuwe allotropen van hoofdgroepelementen. [PDF]. Opgehaald uit: tcichemicals.com
- Dr. Dough Stewart. (2019). Selenium -elementen Feiten. Chemicool. Hersteld van: chemicool.com
- Robert C. Gek. (28 augustus 2019). Selenium. Encyclopædia Britannica. Hersteld van: Britannica.com
- Marques Miguel. (S.F.)). Selenium. Hersteld van: Nautilus.Fis.UC.PT
- Helmestine, Anne Marie, pH.D. (3 juli 2019). Selenium Feiten. Hersteld van: Thoughtco.com
- Lentech B. V. (2019). Periode Tabel: Selenium. Hersteld van: Lentech.com
- Tinggi u. (2008). Selenium: zijn rol als antioxidant in de menselijke gezondheid. Milieugezondheid en medicijnen voorkomen, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Kantoor van voedingssupplementen. (9 juli 2019). Selenium: feitenblad voor gezondheidswerkers. National Institute of Health. Opgehaald uit: SDG.OD.NIH.Gov

