Taka -kenmerken, structuur, functies
- 2773
- 2
- Hugo Crooks
De Sakera, Ook bekend als het tabera-isomaltase-complex, is het een membranaal enzymatisch complex met a-glycosylase-activiteit die behoort tot de groep uitgebreide hydrolasen (bestaande uit glycosidasen en peptidasen).
Het is aanwezig in de darmmicrovings van veel landdieren zoals zoogdieren, vogels en reptielen. Volgens verschillende bibliografische bronnen zijn andere geaccepteerde namen van dit enzym oligo-1,6-glucosidase, a-methylglucosidase, isomaltase en oligosaccharide a-1,6-glucosidase.
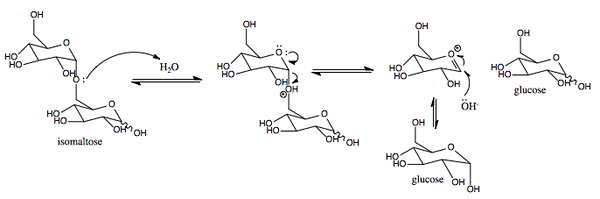
 Grafische weergave van het werkingsmechanisme van Sacas.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
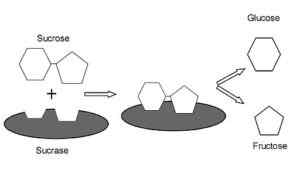
Grafische weergave van het werkingsmechanisme van Sacas.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Het is een enzym met activiteit vergelijkbaar met de omkering werd gevonden in planten en micro -organismen. De primaire functie ervan is om de glucosidebinding tussen monosachariden (glucose en fructose) te hydrolyseren die de sucrose vormen die met voedsel is ingenomen.
Het heeft zeer belangrijke spijsverteringsfuncties, omdat sucrose niet kan worden getransporteerd als een disaccharide in darmcellen en daarom de hydrolyse de darmabsorptie van zijn samenstellende monosachariden mogelijk maakt.
De synthese en activiteit van de aanval-isomaltase in de darmcellen van de dieren wordt op veel niveaus gereguleerd: tijdens transcriptie en translatie, tijdens glycosylatie en ook tijdens de post-translationele verwerking.
Wanneer een van deze gebeurtenissen faalt of een soort mutatie optreedt in het gen dat het codeert, is er bij mensen een pathologische toestand bekend als het sucrose -deficiëntiesyndroom, dat verband houdt met de onmogelijkheid om disacchariden te metaboliseren.
[TOC]
Kenmerken
De disacchariden die dienen als een substraat voor zoogdieren bij zoogdieren zijn meestal het product van de hydrolytische activiteit van speeksel en pancreas a-amylasen-enzymen. Dit is te wijten aan het feit dat Sacas niet alleen de glucosidebindingen van sucrose hydrolyseert, maar ook de α-1,4-bindingen van de maltose en de maltotriosa en andere oligosacchariden.
Het halfleven van hetzelfde varieert tussen 4 en 16 uur, dus darmcellen investeren veel.
Kan u van dienst zijn: wat is de crenation? (Biologie)Synthese
Net als de meeste uitgebreide hydrolase-enzymen, is Sackwaters (vrijer-isomaltase of ja) een gesynthetiseerd glycoproteïne in borstelrandcellen zoals een polypeptide-voorloper aangeduid als pro-if.
Dit voorlopermolecuul wordt getransporteerd naar het apicale oppervlak van de cellen en er wordt enzymatisch verwerkt door pancreasproteasen die het verdelen in twee verschillende subeenheden: de isomaltase -subeenheid en de subunidad -subunidad.
De isomaltase-subeenheid komt overeen met het terminale amino-uiteinde van de pro-Si en heeft een hydrofoob segment (hydrofoob anker) aan zijn N-terminale uiteinde. Hiermee kunt u associëren met het plasmamembraan van darmcellen met een borstelrand.
Het gen dat codeert voor dit complex bij mensen bevindt zich in de lange arm van chromosoom 3 en krijgt de grote homologie van sequentie tussen beide subeenheden (meer dan 40%), er is gesuggereerd dat dit enzym ontstond door een genetische duplicatie -gebeurtenis.
Het is bewezen dat beide subeenheden, isomaltase en sacas, kunnen hydrolyseren.
Structuur
De initiële vorm van het enzym Sacas, het pro-Si polypeptide, heeft ongeveer 260 kDa en 1827 aminozuren. De proteolytische activiteit van pancreasproteasen produceert echter twee subeenheden van 140 kDa en 120 kDa, die respectievelijk de isomaltase en sacaras vertegenwoordigen.
Dit enzym is een glycoproteïne met saccharide -delen N- En OF-Glycosiladas en de studies van hun sequentie onthullen de aanwezigheid van meer dan 19 glycosyleringsplaatsen. Koolhydraatgedeelten vertegenwoordigen meer dan 15% van het gewicht van het eiwit en zijn in wezen samengesteld uit sinaalzuur, galactosamine, hand en N-acetylglucosamine.
Kan u bedienen: Leucine: kenmerken, structuur, functies, biosyntheseAangezien de twee subeenheden van het sacrase-isomaltase-complex niet precies hetzelfde zijn, zijn veel auteurs van mening dat dit enzym in werkelijkheid een heterodimeer is waar elke subeenheid bestaat uit een geglycosyleerde lineaire polypeptideketen en dat het wordt geassocieerd door niet-covalente links.
De isomaltase -subeenheid heeft een hydrofoob segment van 20 aminozuurafval dat betrokken is bij de associatie met het membraan van enterocyten (darmcellen) en die een permanent anker en een peptidesignaal vertegenwoordigen om naar het endoplasmatisch reticulum te gaan.
De actieve plaats van beide subeenheden, sacas en isomaltase, wordt gevonden in het plasmamembraan van enterocyten, die uitsteekt naar darmlumen.
Functie
De belangrijkste metabole functies van enzymen zoals vrijer-isomaltase zijn gerelateerd aan de productie van glucose en fructose van sucrose. Monosachariden die worden getransporteerd naar darmcellen en die worden opgenomen in verschillende metabole routes met verschillende doeleinden.
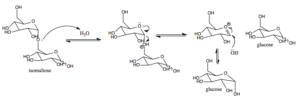 Werkingsmechanisme van suiker-isomaltase bij zoogdieren (Bron: AreID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Werkingsmechanisme van suiker-isomaltase bij zoogdieren (Bron: AreID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Glucose, waarvoor er specifieke transporters zijn, kan intracellulair worden gericht op glycolyse, bijvoorbeeld, waarbij de oxidatie ervan leidt tot de productie van energie in de vorm van ATP en het verminderen van kracht in de vorm van NADH.
Fructose daarentegen kan ook worden gemetaboliseerd door een reeks reacties die beginnen met de fosforylering ervan om fructose 1-fosfaat te fructose en gekatalyseerd door een leverfructochinase. Dit begint de opname van dit substraat op andere energieproductieroutes.
Bovendien heeft de suiker-isomaltase-activiteit, net als bij het enzym dat is omgekeerd in planten, belangrijke implicaties in cellulaire aspecten zoals osmotische druk, die meestal fysiologische gebeurtenissen in staat zijn, zoals groei, ontwikkeling, transport van moleculen en andere.
Menselijk gerelateerde ziekten
Er is een aangeboren autosomale ziekte bij mensen die bekend staan als vrijer-isomaltasa of CSID-deficiëntie (Engels Aangeboren Lindy-isomaltase-tekort), die gerelateerd is aan defecten in oligo-digestie- en osmotisch actieve disacchariden.
Kan u van dienst zijn: Founding EffectDeze ziekte heeft te maken met verschillende gelijktijdige factoren, waaronder de onjuiste vervolging van de pro-if-voorlopervorm van het enzym, genetische mutaties, fouten tijdens transport enz.
Deze aandoening is moeilijk te diagnosticeren en wordt vaak verward met een lactose -intolerantie. Daarom staat het ook bekend als "sucrose -intolerantie".
Het wordt gekenmerkt door de ontwikkeling van buikkrampen, diarree, braken, Jaquecas vergezeld van hypoglykemie, gebrek aan groei en gewichtstoename, angst en overmatige productie van gassen.
Referenties
- Brunner, J., Hauser, h., Braun, h., Wilson, K., Wecker, W., O'Neill, B., & Semenza, g. (1979). De wijze van associatie van het enzymcomplex lygase-isomaltase met het darmborstelgrensmembraan. The Journal of Biological Chemistry, 254(6), 1821-1828.
- Cowell, g., Tranum-Jensen, J., Sjöström, h., & Norén, of. (1986). Topologie en quaternaire structuur van pro-leveren / isomaltase en eindvorm simired / isomaltase. Journal Biochemical, 237, 455-461.
- Hauser, h., & Semenza, g. (1983). Limade-isomaltase: een gestalkte intrinsiek eiwit van het borstelgrensmembraan. Kritische beoordelingen in bioch, 14(4), 319-345.
- Hunziker, W., Spiess, m., Semenza, g., & Lodish, h. F. (1986). Het limade-lsomaltase-complex: primaire structuur, membraan-oriëntatie en evolutie van een gestalkte, intrinsieke borstelgrenseiwit. Cel, 46, 227-234.
- Naim, h. EN., Roth, J., Sterchi, e. EN., Lentze, m., Mijl, p., Schmitz, J., & Hauril, h. (1988). Lind-isomaltase-tekort bij mensen. J. Klin. Investeren., 82, 667-679.
- Rodriguez, ik. R., Taravel, f. R., & Whelan, W. J. (1984). Karakterisering en functie van varkensintestinale linde-isomaltase en zijn afzonderlijke subeenheden. EUR. J. Biochem., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, g. (2012). Suiker. In Ullmann's Encyclopedia of Industrial Chemistry (Vol. 34, p. 72). Wiley-VCH Verlag GmbH & Co. KGAA.
- Triem, W. (negentienvijfennegentig). Aangeboren Lindy-isomaltase-tekort. Journal of Pediatric Gastroenterology and Nutrition, eenentwintig, 1-14.
- « Gastrin -kenmerken, structuur, productie, functies
- De 11 belangrijkste soorten engineering en hun kenmerken »

