Fenol rode kenmerken, voorbereiding, toepassingen
- 1330
- 255
- Nathan Wiegand
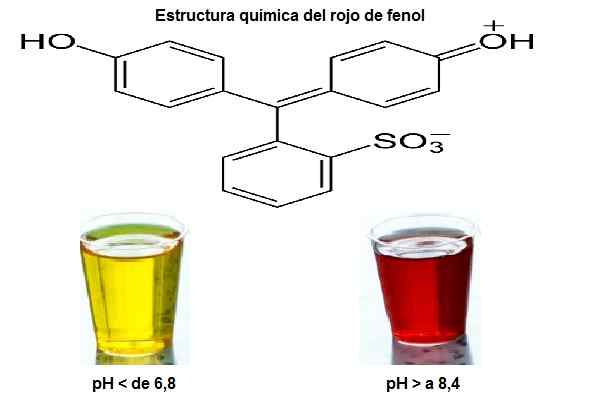
Hij Rood van fenol Het is een organische stofdat heeft de eigenschap van van kleur wanneer deze van alkalisch naar zuur gaat en vice versa. Door dit kenmerk wordt het gebruikt als een zure bas-indicator. Het is ook bekend onder de naam van fenolsulfonfthalein, en de chemische formule is c19H14OF5S.
Deze pH -indicator is geel onder 6,8 en rood boven 8.4. Deze stof is niet carcinogeen, maar het is in staat om de huid en slijmvliezen te irriteren. Phenol Red is een van de meest gebruikte pH -indicatoren in laboratoria.
 Chemische structuur van fenolrood. Kleuren volgens de pH. Bron: Archief: fenol-Rred-zwitterionisch-form-2d-skeletaal.PNG. Wikipedia.com/pxhere. Bewerkte afbeelding.
Chemische structuur van fenolrood. Kleuren volgens de pH. Bron: Archief: fenol-Rred-zwitterionisch-form-2d-skeletaal.PNG. Wikipedia.com/pxhere. Bewerkte afbeelding. Het wordt gebruikt bij het bereiden van belangrijke biochemische tests bij de diagnose en identificatie van bacteriële micro -organismen. Onder de biochemische tests en kweekmedia die fenol rood gebruiken als pH-indicator zijn: Triple Iron Sugar (TSI), Kligler, Ureum, Salty Mannitol Agar, XLD Agar, Bright Green Agar en de Vogel-Johnson Agar.
Rode fenol is ook gebruikt bij de diagnose van infecties door Helicobacter Pylori Via de diagnostische methodologie bekend als chromoendoscopie.
Onlangs is ontdekt dat fenolrood oestrogene activiteit heeft, omdat het een vergelijkbare structuur heeft. Daarom bindt het aan de oestrogeenreceptoren die in sommige cellen aanwezig zijn.
Deze bevinding maakt het gebruik van rode fenol bij de bereiding van cellulaire kweekmedia heroverwogen wanneer hormoongevoelige cellen worden gebruikt.
[TOC]
Kenmerken
Het is een rode indicator voor fenol wordt gekenmerkt door een poeder gevormd te zijn door kleine kristallijne deeltjes van felrode kleur. In oplossing is de vloeistof doorzichtig en licht rood. Het is oplosbaar in alkalische hydroxiden en carbonaten, maar het is matig oplosbaar in water, ethylalcohol en aceton en onoplosbaar in chloroform.
De moleculaire massa is 354,59 g/mol, en het smeltpunt is 285 ° C. De dichtheid is 0,972.
Kan u van dienst zijn: thermoregulatie: fysiologie, mechanismen, typen en wijzigingenVoorbereiding
Om de oplossing te bereiden is het noodzakelijk om 0 te wegen.10 g fenol rood en oplossen in 14.2 ml NaOH (natriumhydroxide) 0.020 m. Vervolgens compleet met gedestilleerd water tot een laatste volume van 250 ml.
Het moet worden bewaard bij kamertemperatuur, op een droge en goed geventileerde plaats.
Toepassingen
Als pH -indicator
Het belangrijkste gebruik ervan is omschreven om aan kweekmedia te worden toegevoegd voor de diagnose en identificatie van bacteriële micro -organismen. De rode pH -pH -indicator is opgenomen in die media waarin we willen laten zien of het micro -organisme bepaalde koolhydraten heeft kunnen gisten.
Koolhydraatfermentatie genereert zure vorming. Daarom zullen de koloniën en het kweekmedium geel worden. Als er daarentegen geen koolhydraatfermentatie is, dan zal het micro -organisme de huidige peptones gebruiken. Dit alkaliseert het medium, dat zich tot de rode kleur zal richten.
Onder de biochemische tests die fenol rood gebruiken, zijn de volgende: Media Triple Iron Sug. Terwijl de media en differentiële culturen die fenol rood gebruiken Salty Mannitol Agar, XLD Agar, Bright Green Agar en Vogel-Johnson Agar zijn.
Aan de andere kant gebruikt de ureumtest ook fenol rood als een pH -indicator, maar in dit geval wat bewijs moet zijn (ammoniak). In dit geval is er een Fuchsia -kleurwending.
In het geval dat de ureasa niet aanwezig is, blijft het medium dezelfde kleur.
Chromoendoscopie met fenolrood
Hernández en medewerkers gebruikten de rode indicator van 0,1% plus ureum op 5% om het maagslijmvlies te evalueren en de aanwezigheid van te diagnosticeren Helicobacter Pylori. Deze techniek wordt chromoendoscopie genoemd en maakt deel uit van de tests die bekend staan als reactieven.
Kan u van dienst zijn: biotische en abiotische factorenDeze techniek heeft het voordeel om de letselsite efficiënt te lokaliseren, vervuiling te vermijden en onmiddellijk te lezen. Gele kleuring wordt geïnterpreteerd als negatief, en kleuring van rood-fucsia wordt geïnterpreteerd als een positieve reactie.
Onderzoek met de rode pH -pH -indicator
Verschillende onderzoeken hebben aangetoond dat fenolrood een chemische structuur heeft die vergelijkbaar is met bepaalde niet -steroïde oestrogeen; En in weefselcultuurmedia heeft het oestrogene activiteit, omdat het de eigenschap heeft om de oestrogeenontvanger aan te sluiten wanneer deze zich in concentraties tussen 15 - 45 μg bevindt.
Vooral is gezien dat de oestrogeenontvanger van MCF-7 menselijke borstkankercellen efficiënt is verbonden, met een affiniteit van 0,001%.
Dit is een zeer belangrijke bevinding, omdat onderzoekers hebben geprobeerd om oestrogeenvrije cellulaire media te verkrijgen, zodat cellen niet worden gestimuleerd. Hiervoor hadden ze geprobeerd serumestrogenen te elimineren, maar ze hadden nooit gedacht dat een stof die deel uitmaakte van het kweekmedium hormonale actie kon simuleren.
Daarom moet in deze zin het gebruik van media van cellulaire gewassen die fenolrood bevatten, worden heroverwogen wanneer oestrogeengevoelige cellen worden gebruikt.
Toxiciteit
Voor de manipulatie van het rood van Fenol wordt het gebruik van instrumenten en bioveiligheidsmaatregelen aanbevolen.
In het geval van toevallige lekkage is het noodzakelijk om de stof mechanisch te verzamelen met absorberende materialen. Weggooien in de juiste container. Het mag niet uit de drainage worden gegoten.
Risico's
De NFPA (National Fire Protection Association) classificeert Fenol Red met een gezondheidsrisico 2. Dit betekent een gematigd risico. Aan de andere kant wordt het in termen van ontvlambaarheid en reactiviteit geclassificeerd als respectievelijk 1 en 0; dat wil zeggen, er is een klein risico op ontvlambaarheid en er is geen risico op reactiviteit.
Wat betreft de schade veroorzaakt door rode fenol om contact te sturen, kan de irritatie van de huid en het oogslijmvlies worden genoemd. Het is ook schadelijk als het alleen in grote hoeveelheden wordt ingenomen. Inademing is niet gevaarlijk en is niet kankerverwekkend.
Het kan je van dienst zijn: mariene biologie: wat is het, welke studies, takkenE.H.B.O
In het geval van huid- en slijmcontact wordt aanbevolen om het getroffen gebied 15 minuten met veel water te wassen, waarbij de oogleden worden opgeheven.
Op huidniveau kan een verzachtende crème in het getroffen gebied worden geplaatst om irritatie te verlichten. Als irritatie aanhoudt, is het noodzakelijk om naar de dokter te gaan.
In het geval van een milde inname moet de mond worden gespoeld. Als inname in aanzienlijk volume was, is het essentieel om onmiddellijke medische hulp te zoeken. Veroorzaken geen braken of het geven van melk.
Onverenigbaarheid met andere stoffen
Er moet voor worden gezet dat fenolrood geen contact maakt. Met allemaal kunt u gewelddadig reageren (explosief) en vuur veroorzaken.
Referenties
-
Berthois en, Katzenellenbogen JA, Katzenellenbogen BS. Fenol rood in weefselkweekmedia is een zwak estagen: implicaties die de studie van oestrogeenresignerende cellen in kweek samenvoegen. Proc Natl Acad Sci u s a. 1986; 83 (8): 2496-2500.
-
MSD's met rode veiligheidsschema's. Nationale Universiteit van Heredia. Costa Rica. Chemieschool. Beschikbaar bij: gebruikers/team/downloads/rood%20fenol.PDF
-
Roth. Fenol Red Safety Data Sheet. 2015. Spanje. Beschikbaar op: Carlroth.com
-
Chemische en geassocieerde ingenieurs. Rood van pH -wateren. Veiligheidsblad. Colombia. Beschikbaar bij: omzet.com
-
Neogen. Rode Breck -basis van Fenol. Beschikbaar op: Foodsafety.Neogen.com
-
Hernández H, Castellanos V, González L, Infante M, Peña K, Andrain en. Chromoendoscopie met fenol rood bij de diagnose van infectie door Helicobacter Pylori. Spaans Vijsterde ziekten Magazine. 2012; 104 (1). Beschikbaar bij: Scielo.borg
-
Marín J, Díaz J, Solís J. Chromoendoscopie in Helicobacter pylori -infectie: is het een reactietijd? Spaans Journal of Digestive Diseases: Official Organ of the Spaanse Society of Digestive Pathology. 2011; 104 (1): 01-03. Beschikbaar bij: ResearchGate.netto

