Zinkregel of maximale veelheid

- 2253
- 707
- Aaron Okuneva
We leggen uit wat de Hund -regel of het principe van maximale multipliciteit is, stappen om deze toe te passen en verschillende voorbeelden te geven
 Bron: Gabriel Bolívar
Bron: Gabriel Bolívar Wat is de zinkregel?
De Zinkregel, Ook wel maximaal multipliciteitsprincipe van spin genoemd, het is een empirische regel die wordt gebruikt om de absolute elektronische configuratie van de chemische elementen te schrijven wanneer ze zich in hun fundamentele staat bevinden. Dat wil zeggen, het is een regel die helpt voorspellen hoe elektronen worden verdeeld in de atoomorbitalen van een atoom dat ontspannen is of op het laagste niveau van energie.
De regel van Sink zegt:
"... in een atoom dat zich in zijn fundamentele staat bevindt, zullen elektronen van hetzelfde energieniveau zodanig worden verdeeld dat er zoveel mogelijk parallelle stekels zijn".
Deze regel komt overeen met een van de fundamentele principes van de kwantummechanica en de huidige atoomtheorie. Het is erg handig om enkele eigenschappen van de verschillende elementen te begrijpen, vooral hun magnetische eigenschappen. Dit komt omdat atomen worden aangetrokken of afgestoten door magneten omdat ze in hun structuur worden verdwenen.
Waar komt de gootsteen- of maximale multipliciteitsregel vandaan??
Atoomspectra
Dit principe kondigde eerst de Duitse fysicus Friedrich in 1927 uit. Sink bestudeerde atoomabsorptiespectra, die het mogelijk maken om experimenteel de energie te meten die elektronen absorberen wanneer blootgesteld aan elektromagnetische straling van adequate golflengte. Experimentele waarnemingen konden alleen worden verklaard als het atoom zoveel mogelijk elektronen bezat met dezelfde spin.
Ontbrekende elektronen
Naast de atoomspectra zijn er andere experimentele waarnemingen die de elektronische configuraties bevestigen die worden voorspeld door de Hund Rule toe te passen. De belangrijkste bestaat uit de experimentele maatregelen van de magnetische eigenschappen van atomen die het mogelijk maken te bepalen hoeveel ontbrekende elektronen een atoom hebben.
Het kan u van dienst zijn: waterelektrolyseDe ontbrekende elektronen zijn die die alleen in een orbitaal zijn, zonder hun respectieve tegenovergestelde spinpaar.
Stappen om de zinkregel toe te passen
De zinkregel is van toepassing wanneer we de elektronische configuratie van een atoom schrijven in zijn fundamentele staat. Dit betekent dat het een aanvullende regel van andere regels is, zoals het AUFBAU -principe of constructieprincipe (ook wel de regenregel genoemd) en het principe van uitsluiting van Pauli.
Geldt alleen op die gevallen waarin we willen.
Bovendien is het alleen maar zinvol om het toe te passen voor de Valencia -laag, dat wil zeggen dat dat niveau van energie dat onvolledig is (het heeft niet alle elektronen die erin passen). Anders zouden alle elektronen worden gekoppeld om te voldoen aan het uitsluitingsprincipe van Pauli.
De toepassing van deze regel bestaat uit de volgende stappen:
- Stap 1: Teken een horizontale lijn of een kleine rechthoek voor elk orbitaal van het subniveau.
- Stap 2: Plaats het eerste elektron in het eerste orbitaal met uw spin wijst.
- Stap 3: Plaats het volgende elektron in de volgende orbital, ook wijst op.
- Stap 4: Ga zo door totdat elektronen voorbij zijn of er geen lege orbitalen meer zijn.
- Stap 5: Als bij het plaatsen van een elektron in elk orbitaal nog steeds elektronen zijn om te verdeeld worden, herhaal dan stap 2 tot 4 maar plaatst de elektronen met hun spin naar beneden.
Laten we een aantal voorbeelden analyseren om te begrijpen hoe deze stappen van toepassing zijn.
Voorbeeld 1: Stikstofelektronische configuratie
Stikstof is element nummer 7, dus het heeft in totaal 7 elektronen die rond de kern draaien. Deze elektronen worden als volgt verdeeld, volgens de regenregel:
Kan u van dienst zijn: acetanylide (c8h9no)1s2 2s2 2 p3
Zoals we kunnen zien, komt de stikstofvalentlaag overeen met niveau 2 van energie (laag lag l) waarin 8 elektronen passen. Stikstof heeft echter slechts 5 Valencia -elektronen.
In de orbitalen S Slechts 2 elektronen passen, dus de 2s orbital is volledig vol en heeft geen zin om de gootsteenregel voor dit orbitaal toe te passen.
Aan de andere kant is het 2p sub -niveau, dat 3 orbitalen bevat, niet vol. Maar hoe worden deze 3 elektronen verdeeld in die drie orbitalen? Ze worden verdeeld na de stappen van de gootsteenregel, die hieronder worden gepresenteerd:
Stap 1: Teken een horizontale lijn of een kleine rechthoek voor elk orbitaal van het subniveau.
Omdat het het 2p sub -niveau is, zijn er drie orbitalen die de 2p zijnX, 2 pEn en de 2pZ. We moeten dus drie horizontale strepen of drie dozen of rechthoeken tekenen:
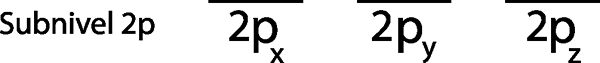
Elk van deze strepen of dozen vertegenwoordigt een orbitaal, zoals aangegeven door de naam die elk van hen heeft neergehaald.
Stap 2: Plaats het eerste elektron in het eerste orbitaal met uw spin wijst.
We plaatsen het eerste elektron in de 2p orbitalX Omdat dit de eerste orbital op de lijst is.
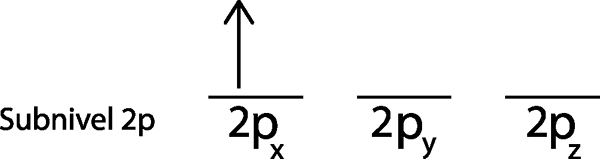
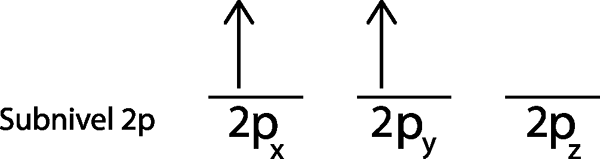
Stap 3: Plaats het volgende elektron in de volgende orbital, ook wijst op.
Het tweede elektron bevindt zich in de 2p orbitalEn
Stap 4: Ga zo door totdat elektronen voorbij zijn of er geen lege orbitalen meer zijn.
In ons geval moeten we gewoon 3 elektronen distribueren, dus we moeten alleen het laatste elektron plaatsen in de laatste orbitale en voila:
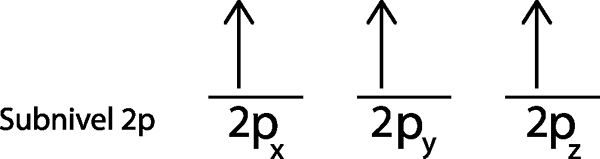
Zoals te zien is, voorspelt het principe van maximale multipliciteit of zinkregel dat atomaire stikstof 3 vermiste elektronen moet hebben.
Kan u van dienst zijn: stikstofoxiden (NOx)In dit geval was het niet nodig om stap 5 toe te passen, omdat we na stap 4 zonder elektronen werden achtergelaten om te distribueren.
Voorbeeld 2: Iron Electronic Configuration
IJzer is element 26 en de elektronische configuratie is:
1s2 2s2 2 p6 3S2 3P6 3D6 4S2
In dit geval kunnen we opmerken dat het orbitaal met het hoogste energieniveau 4s is, maar omdat het een overgangsmetaal is, heeft ijzer een gedeeltelijk volledige orbitale d. Dit is de orbitale wiens elektronen we zullen verdelen na de Hund -regel.
Stap 1: Teken een horizontale lijn of een kleine rechthoek voor elk orbitaal van het subniveau.
We vullen het 3D -subniveau dat 5 orbitalen bevat:
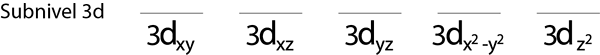
Stap 2: Plaats het eerste elektron in het eerste orbitaal met uw spin wijst.
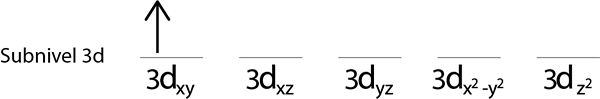
Stappen 3: Plaats het volgende elektron in het volgende orbitaal, ook wijst op.
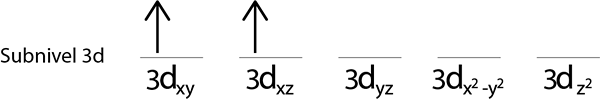
Stap 4: Ga zo door totdat elektronen voorbij zijn of er geen lege orbitalen meer zijn.
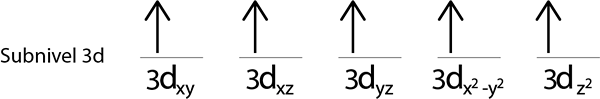
Stap 5: Als bij het plaatsen van een elektron in elk orbitaal nog steeds elektronen zijn om te verdeeld worden, herhaal dan stap 2 tot 4 maar plaatst de elektronen met hun spin naar beneden.
Omdat we nog steeds een elektron hebben om te distribueren na het plaatsen van een elektron in elke 3D -orbital, wordt de laatste van de 6 elektronen geplaatst met de tegenovergestelde spin in het eerste orbitaal.
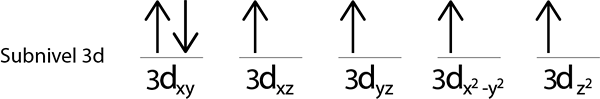
Dit is de absolute configuratie van een ijzeratoom in zijn fundamentele staat. In hetzelfde heeft ijzer 4 ontbrekende elektronen met parallelle stekels.
Referenties
- Zonder antwoord vragen over de maximale multipliciteit of gootsteenregel: wat moet worden gedaan (2020). Uit de Physis andquimica genomen.com.
- Sink - chemie (2021). Ontleend aan CostProject.borg.
- Maximale veelheid van Sind (2020). Uit Principiode genomen.com.
- Zinkregel | The Chemistry Guide (2012). Uitgevoerd uit chemie.Laguia2000.com.

