Exotherme en endotherme reacties
- 4379
- 797
- James Dach
 Verbranding is een voorbeeld van exotherme reactie, omdat het warmte vrijgeeft. Van zijn kant smelt ijs door een endotherme reactie, omdat het thermische energie vereist
Verbranding is een voorbeeld van exotherme reactie, omdat het warmte vrijgeeft. Van zijn kant smelt ijs door een endotherme reactie, omdat het thermische energie vereist De exotherme en endotherme reacties Ze verschillen in het feit dat de eerste thermische energie van de eerste afgifte, terwijl de laatste het absorbeert, volgens de warmteveranderingen die optreden tijdens chemische reacties.
Evenzo kunnen andere soorten energie betrokken zijn bij chemische reacties, omdat soms tijdens de reactie lichte energie, geluidsenergie en zelfs elektriciteit worden geproduceerd.
Rekening houdend met niet alleen warmte, maar andere soorten energie, worden chemische reacties geclassificeerd als exergonisch En Endermanica. Een exergonische reactie laat energie vrij wanneer ze worden geproduceerd, terwijl een endegonic het absorbeert.
In dit geval is een exotherme reactie ook een exergonische reactie, omdat deze warmte vrijgeeft. Een van de meest bekende voorbeelden is verbranding. Elke keer dat een stuk hout wordt verbrand, wordt calorisch en heldere energie vrijgegeven.
Aan de andere kant treedt een van de bekendste chemische reacties op bij het smelten van een ijsblokje, omdat ijs de thermische energie van de omgeving absorbeert om te transformeren in vloeibaar water.
Een exotherme reactie kan spontaan optreden, hoewel u soms wat werk moet doen om te beginnen. Om een endotherme reactie te laten plaatsvinden, is het echter altijd noodzakelijk dat de omgeving een taak op het systeem doet.
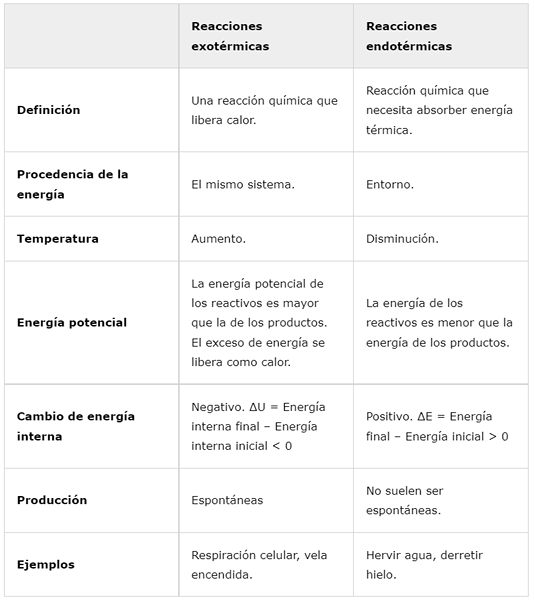
Exotherme reacties | Endotherme reacties | |
Definitie | Een chemische reactie die warmte vrijgeeft. | Chemische reactie die thermische energie moet absorberen. |
Oorsprong van energie | Hetzelfde systeem. | Rondom. |
Temperatuur | Toename. | Afname. |
Potentiële energie | De potentiële energie van de reagentia is groter dan die van de producten. Overtollige energie wordt vrijgegeven als warmte. | De energie van de reagentia is minder dan de energie van de producten. |
Interne energieverandering | Negatief. ΔU = uiteindelijke interne energie - initiële interne energie < 0 | Positief. ΔE = Eind energie - Initiële energie> 0 |
Productie | Spontaan | Ze zijn meestal niet spontaan. |
Voorbeelden | Cellulaire ademhaling, brandende kaars. | Kook water, smelt ijs. |
Exotherme reacties
Definitie
Type chemische reactie die warmte vrijgeeft wanneer het wordt uitgevoerd.
Het kan u van dienst zijn: cyclohexen: structuur, eigenschappen, synthese en gebruikOorsprong van energie
Hetzelfde systeem biedt energie zodat de reactie optreedt.
Temperatuur
Na de reactie is er een toename van temperatuur.
Potentiële energie
Wanneer een chemische reactie optreedt tussen de reagentia, worden verbanden tussen hen verbroken en andere worden gevormd om nieuwe moleculen te creëren. Maar niet alle links verenigen atomen en moleculen met dezelfde kracht, daarom is energie om te breken of te maken elke link anders.
Tijdens elke reactie breken ze en creëren ze verschillende aantallen links, dus energie is anders. In een exotherme reactie, de potentiële energie van de reagentia is ouder dan die van de producten, en omdat de energie wordt bewaard, wordt het overtollige vrijgegeven als warmte.
Interne energieverandering
Interne energie is gerelateerd aan het vermogen van het systeem om werk uit te voeren, en omvat de potentiële energie en kinetische energie. De absolute energie van het systeem wordt niet bepaald, maar de variatie ervan, Δu genoemd.
Volgens wat er in de vorige sectie werd gezegd, is de verandering van interne energie Δu negatief.
Δu = uiteindelijke interne energie - initiële interne energie < 0
Productie
De meeste exotherme reacties zijn spontaan, dat wil zeggen dat ze voor zichzelf plaatsvinden, zonder de noodzaak om externe energie toe te voegen, totdat de reagentia zijn uitgeput.
Voorbeelden
Normaal gesproken zijn oxidatiereacties en die die leiden tot samengestelde vorming meestal exotherme reacties:
1. Los wasmiddel op in water
Bij het oplossen van kledingstof in een beetje koud water, voelt hij zich warm als hij het aanraakt.
2. Cellulaire ademhaling
In dieren en planten wordt het cellulaire ademhalingsproces uitgevoerd als onderdeel van de koolstofcyclus. Ademen maakt gebruik van glucose en zuurstof om koolstofdioxide, water en energie terug te geven, volgens de reactie:
Kan u dienen: titaniumoxide (iv): structuur, eigenschappen, gebruikC6H12OF6 + 6e2 → 6co2 + H2O + energie (ATP)
3. Een brandende kaars
Naast licht geeft een brandende kaars warmte en andere stoffen af:
Zuurstofzuurstof → water + koolstofdioxide + licht en warmte
4. De bombardementen
Dit insect verdedigt zichzelf door een aerosol te sprenkelen over zijn roofdieren. De kever houdt vloeistoffen en enzymen in afzonderlijke compartimenten, gelegen in de buik.
Wanneer het wordt bedreigd, verdrijft het de vloeistoffen naar het enzymcompartiment en een chemische reactie die stoom en warmte genereert, wordt geproduceerd, en werkt als een afstotend voor mogelijke roofdieren.
5. Stalen en azijnwol
Een metaalachtig ijzer wordt langzaam geoxideerd bij het reageren met de omgeving, maar als azijn wordt toegevoegd aan een beetje staalwol, wordt waargenomen dat oxidatie veel sneller is en tegelijkertijd warmte genereert.
Endotherme reacties
Definitie
Reacties waarbij reagentia thermische energie moeten absorberen zodat de producten worden verkregen.
Oorsprong van energie
De energie die nodig is om de reactie te uitvoeren, komt uit van de omgeving.
Temperatuur
De endotherme reactie houdt een afname van temperatuur.
Potentiële energie
In tegenstelling tot wat er gebeurt met een exotherme reactie, de energie van de reagentia Het is minder dat de energie van de producten.
Interne energieverandering
In een endotherme reactie is de verandering van interne energie AE positief.
ΔE = uiteindelijke energie - initiële energie> 0
Daarom is de uiteindelijke energie groter dan de initiële.
Productie
Endothermische reacties vereisen dat er werk aan het systeem wordt gedaan, zodat ze meestal niet spontaan zijn.
Er zijn echter enkele endotherme reacties, zoals het smelten van ijs en de verdamping van bepaalde vloeistoffen, die spontaan zijn bij kamertemperatuur.
Er wordt dan geconcludeerd dat de temperatuur van de omgeving een bepalende factor is in de spontaniteit van een chemische reactie.
Het kan u van dienst zijn: chemische indicatoren: waar zijn ze voor, typen, voorbeeldenVoorbeelden
Veel van de reacties met het oplossen van zouten en, in het algemeen, drugsontleding, zijn meestal endotherm. Op dezelfde manier zijn de doorgang van ijs tot vloeibaar water, en van stoomvloeistofwater, dat wil zeggen de transformaties van de toestand, ook endotherm reacties.
1. Fotosynthese
De planten voeren een chemische reactie uit in aanwezigheid van zonlicht, waarbij ze koolstofdioxide en water omzetten in glucose en zuurstof. Chlorofyl is het belangrijkste molecuul in dit proces, waarvan de chemische reactie is:
Licht + 6co2 + H2O → C6H12OF6 + 6e2
Zoals te zien is, is het de omgekeerde reactie van ademhaling. Om een kilogram glucose te produceren, zijn 15 mega joules van zonne -energie nodig.
2. Kook water en kook
Een veel voorkomende reactie, die energie vereist om verder te gaan, is kokend water:
H2O (vloeistof) + energie → h2O (Steam)
Voedingsmiddelen hebben normaal gesproken water nodig om te koken, en op dezelfde manier moet het water dat ze bevatten verdampen om ze te koken, waarbij een staatsverandering inhoudt.
3. Om het ijs te smelten
Evenzo is het gebruikelijk dat ijs bij kamertemperatuur smelt, als dit groter is dan 0 ° C:
H2O (vast) + energie → h2O (vloeistof)
Daarom koelt het drankje bij het toevoegen van ijs, omdat het de energie absorbeert die nodig is om van de vloeistof te veranderen.
4. Koude tassen
Ze worden gebruikt om kneuzingen en slagen te behandelen. Bevatten water en een envelop met ammoniumchloride. Bij het tikken op de zak wordt de envelop verbroken en de reactie van ammoniumchloride met water, dat endotherm is, koelt de zak en verlicht pijn.
5. Ozonproductie
Ultraviolette straling van de zon verandert zuurstof in ozon, waardoor warmte wordt vrijgelaten in het proces.
3e2 (Gas) + Ultraviolet Light → 2e3 (gas)
Referenties
- Byju's. Verschil tussen edotherm en exotherme reacties. Hersteld van byjus.com
- Chang, R. (2013). Scheikunde. 11VA. Editie. McGraw Hill Education.
- Grelaan. Exotherme reacties om dingen te verwarmen. Hersteld van: Grelane.com.
- Hein, m. (2014). Foundations of College Chemistry. Wiley.
- Helmestine, een. Inzicht in endotherme en exotherme reacties. Hersteld van: Thoughtco.com

