Endergonische reactie

- 3216
- 141
- Pete Heaney V
 Een endaire reactie is dat niet -spontaan en dat vereist veel energie
Een endaire reactie is dat niet -spontaan en dat vereist veel energie Wat is een endaire reactie?
A Endergonische reactie Het is er een die niet spontaan is en ook een hoge energievoorziening vereist. In de chemie is deze energie meestal het calorie. De bekendste van alle endothermische reacties zijn endotherm reacties, dat wil zeggen die die warmte absorberen te optreden.
De reden waarom niet alle reacties spontaan zijn, is omdat ze energie verbruiken, en de door de betrokken soorten gevormde systemen verminderen hun entropie. Met andere woorden, voor chemische doeleinden worden ze moleculair meer ordelijk.
Het bouwen van een bakstenen muur is een voorbeeld van een endaire reactie. Bakstenen alleen zijn niet compact genoeg om een vast lichaam te vormen. Dit komt omdat er geen energiewinst is die zijn unie bevordert (ook weerspiegeld in zijn mogelijke lage intermoleculaire interacties).
Om de muur te bouwen, heb je cement en arbeid nodig. Dit is energie, en de niet -spontane reactie (de wand zal niet automatisch worden gebouwd) wordt mogelijk als een energievoordeel wordt waargenomen (economisch, in het geval van de muur).
Als er geen voordeel is, zal de muur instorten bij enige verstoring en kunnen hun bakstenen nooit verenigd blijven. Hetzelfde geldt voor veel chemische verbindingen, waarvan de bouwblokken niet spontaan kunnen toetreden.
Kenmerken van een endaire reactie
- Het is niet spontaan.
- Warmte absorberen (of ander type energie).
De reden is dat hun producten meer energie hebben dan de reagentia die bij de reactie betrokken zijn. Het bovenstaande kan worden weergegeven met de volgende vergelijking:
Δg = gProducten-GReagentia
Waarbij ΔG de verandering van vrije energie van Gibbs is. Als gProduct is groter (omdat het energieker is) dan GReagentia, De aftrekking moet groter zijn dan nul (ΔG> 0). De volgende afbeelding vat de nieuw uitgelegde samen:
Kan u dienen: natriumsulfaat (Na2SO4): structuur, eigenschappen, gebruik, verkrijgen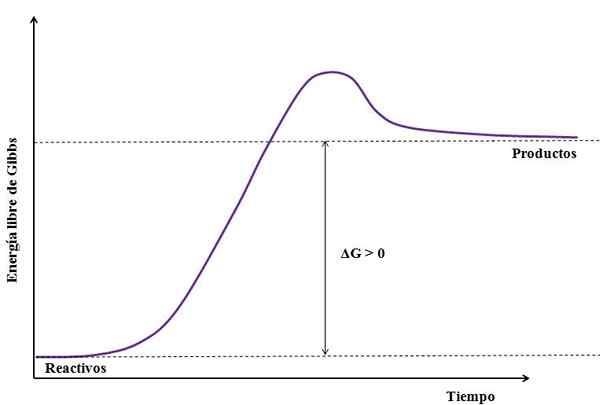 Figuur van een endergele reactie. Bron: Gabriel Bolívar
Figuur van een endergele reactie. Bron: Gabriel Bolívar Let op het verschil tussen energietoestanden tussen producten en reagentia (paarse lijn). Daarom transformeren de reagentia niet in producten (a+b => c) als er eerst geen warmteabsorptie is.
Verhoog vrije energie -energie
Elke endergonische reactie heeft een toename van systeemvrije energie van het systeem. Als voor een bepaalde reactie wordt vervuld dat ΔG> 0, dan is het niet spontaan en vereist het een energievoorziening.
Hoe je wiskundig weet of een reactie al dan niet endegonic is? De volgende vergelijking toepassen:
Δg = ΔH-Tδs
Waarbij ΔH de enthalpie van de reactie is, dat wil zeggen, de totale energie die wordt vrijgegeven of geabsorbeerd, is ΔS de verandering van entropie en t de temperatuur. De TδS -factor is het verlies van energie dat niet wordt geëxploiteerd bij de expansie of het bestellen van de moleculen in een fase (vaste, vloeistof of frisdrank).
AG is dus de energie die het systeem kan gebruiken om een taak uit te voeren. Aangezien Ag een positief teken heeft voor een endaire reactie, moet energie of werk (reagentia) worden toegepast om de producten te verkrijgen.
Dus, wetende de AH -waarden (positief, voor een endotherme reactie en negatief, voor een exotherme reactie) en Tδs, kunt u weten of de reactie eindgononisch is.
Dit betekent dat, hoewel een reactie endotherm is, Nee Het is noodzakelijkerwijs endogonisch.
De ijsblokje
Een ijsblokje smelt bijvoorbeeld in vloeibaar waterabsorberende warmte, wat helpt bij het scheiden van zijn moleculen; Het proces is echter spontaan en daarom is het geen endaire reactie.
In het geval dat het ijs is gebaseerd op een temperatuur ver onder van100 ° C, wordt de term Tδs van de vrije energievergelijking klein in vergelijking met ΔH (omdat t afneemt), en als gevolg daarvan zal ΔG een positieve waarde hebben.
Kan u van dienst zijn: carbonzuurMet andere woorden: smelt het ijs onder -100 ° C is een endegonisch proces en het is niet spontaan. Een soortgelijk geval is om water rond 50 ° C te bevriezen, wat niet spontaan gebeurt.
De links van hun producten zijn zwakker
Een ander belangrijk kenmerk, ook gerelateerd aan ΔG, is de energie van nieuwe links. De links van de gevormde producten zijn zwakker dan die van de reagentia.
De afname van de kracht van de links wordt echter gecompenseerd met een massa -winst, die wordt weerspiegeld in de fysieke eigenschappen.
Hier begint de vergelijking met de bakstenen muur de betekenis te verliezen. Volgens het bovenstaande moeten de staven in de stenen sterker zijn dan die tussen hen en het cement. De muur als geheel is echter rigide en resistenter om een grotere massa te hebben.
Het is gekoppeld aan exergonische reacties
Als de eind -brekende reacties niet spontaan zijn, hoe vinden ze dan in de natuur plaats? Het antwoord is te wijten aan koppeling met andere reacties die behoorlijk spontaan (exergonisch) zijn en die op de een of andere manier hun ontwikkeling bevorderen.
De volgende chemische vergelijking vertegenwoordigt bijvoorbeeld dit punt:
A + B => C (Endergonische reactie)
C + D => E (exergonische reactie)
De eerste reactie is niet spontaan, dus het kon natuurlijk niet gebeuren. Door de productie van C kan echter de tweede reactie optreden, waardoor en.
Gibbs -vrije energieën toevoegen voor de twee reacties, ΔG1 en ΔG2, Met een resultaat minder dan nul (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Het kan u van dienst zijn: HydrorsAls C niet zou reageren met D, zou ik het nooit kunnen vormen, omdat ik geen energieverbinding had (als het geval van geld met de bakstenen muur). Er wordt dan gezegd dat C en D "Jalan" op A en B om te reageren, zelfs een endegonische reactie.
Voorbeelden van endeergonische reacties
Fotosynthese
Planten gebruiken zonne -energie om koolhydraten en zuurstof te creëren uit kooldioxide en water. De co₂ en o2, Kleine moleculen met sterke verbindingen, vormen suikers, van tarrystructuren, die zwaarder, vast zijn en smelten bij een temperatuur rond 186 ° C.
Merk op dat de C-C, C-H en C-O-verbanden zwakker zijn dan die van O = C = O en O = O. En vanuit een suikereenheid kan de plant polysachariden synthetiseren, zoals cellulose.
Synthese van biomoleculen en macromoleculen
Endermanische reacties maken deel uit van anabole processen. Net als koolhydraten vereisen andere biomoleculen, zoals eiwitten en lipiden, complexe mechanismen die zonder hen zijn, en koppelen met de hydrolysereactie van de ATP, kan er niet zijn.
De vorming van diamanten en zware stoffen van ruwe olie
Diamanten vereisen enorme druk en temperaturen, zodat hun componenten kunnen compacteren in een kristallijne vaste stof.
Sommige kristallisaties zijn echter spontaan, hoewel ze met zeer lage snelheden passeren (spontaniteit is niet gerelateerd aan de kinetiek van de reactie).
Ten slotte vertegenwoordigt ruwe olie alleen een product van enderergonische reacties, vooral zware koolwaterstoffen of macromoleculen die asfaltenen worden genoemd.
Hun structuren zijn zeer complex en hun synthese heeft veel tijd nodig (miljoenen jaren), hitte en bacteriële werking.
Andere voorbeelden
- Cellulaire ademhaling van planten.
- Het transport van zuurstof in de bloedbaan.
- De diffusie van ionen door celmembranen.
- Spiercontractie.
- Cel -eiwitsynthese.
Referenties
- Endermanische en exeronische reacties. Hersteld van Quimitube.com
- Gratis energie. Hersteld van ES.Khanacademy.borg
- Definitie van Endergonic Reaction. Opgehaald uit de biologie.netto

