Structuurradio, eigenschappen, gebruik, verkrijgen
- 4404
- 504
- Nathan Wiegand
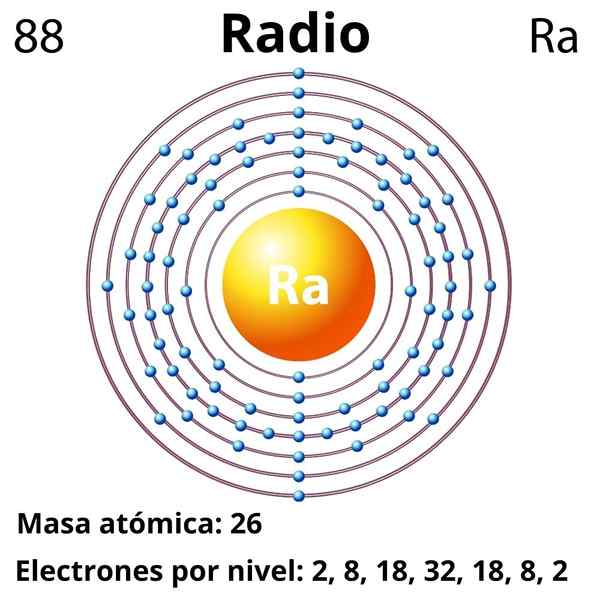
Hij radio Het is een metaalelement dat behoort tot groep 2 van de periodiek systeem, de alkalinotherreuze metalen, waarvan het chemische symbool RA is. Het is het laatste lid van deze groep, gelegen onder het barium, en voorgaande radioactieve elementen zoals thorium en uranium; De straal is echter ongeveer een miljoen keer meer radioactief en daarom gevaarlijker dan uranium zelf.
Het is een element omgeven door ongelooflijke en ongelukkige verhalen, allemaal als gevolg van de onwetendheid van de negatieve effecten op de gezondheid. The bluish brightness of their salts and aqueous solutions captivated scientists Pierre and Marie Curie, who discovered it in the year of 1898 analyzing an inexplicable and strong radiation from samples of the Pechblenda ore, to which their uranium and uranium content had removed their uranium content and polonium.
 Illustratie door Marie Curie, ontdekker van de radio
Illustratie door Marie Curie, ontdekker van de radio Elimineerde uranium en polonium, de Curie en concludeerden dat er een ander element aanwezig was in de Pechblenda, verantwoordelijk voor de sterke straling, die ingenieus kon kwantificeren. Dit nieuwe element leek chemisch erg op barium; In tegenstelling tot zijn spectrale groene lijnen, waren die hiervan echter van een karminekleur.
Dus na het verwerken, zuiveren en analyseren van tonnen pechblenda, verkregen ze 0.1 mg racl2. Tegen die tijd, in 1902, hadden ze de atoommassa van de radio al bepaald, wiens naam afgeleid van het Latijnse woord 'straal', wat 'ray' betekent. De radio is letterlijk een stralend element.
Acht later, in 1910, slaagde Marie Curie samen met de Franse chemicus André Louis Debierne erin om de straal in hun metalen vorm te isoleren door racl -elektrolyse2 Mercurius gebruiken. De onderzoekskoorts werd geboren, wat later een alarmerend commercieel, cultureel en medicinaal sensatie werd.
[TOC]
Structuur
De radio is een metaal waarvan de atomen erg omvangrijk zijn. Een gevolg hiervan is dat hun kristallen weinig dicht zijn (hoewel iets meer dan die van Bario) en een kubieke structuur aannemen die op het lichaam is gecentreerd (BCC). Uit deze structuur wordt geen andere alotrope gerapporteerd aan andere temperaturen of drukken.
Elektronische configuratie

De elektronische configuratie voor de radio is als volgt:
[RN] 7s2
Het oxideert met enorm gemak om het kation ra te worden2+, die isolectronisch is tot nobel radongas. Daarom bevatten alle straalverbindingen het kation RA2+, het vaststellen van overwegend ionische interacties; Naar schatting is het mogelijk dat het vanwege relativistische effecten links kan vormen met een opmerkelijk covalente karakter (RA-X).
Kan u van dienst zijn: kaliumbenzoaat: structuur, eigenschappen, verkrijgen, gebruikRadio -eigenschappen
 Radiocompound monster
Radiocompound monster Fysiek uiterlijk
De radio is een zilveren wit metaal, dat onmiddellijk verven geel en donkerder wordt bij het reageren met de stikstof uit de lucht om zijn nitruro, ra te vormen3N2. Omdat het zo moeilijk te manipuleren is, zijn er weinig fysieke kenmerken van de straal die rechtstreeks zijn bepaald.
Atoomnummer
88
Molaire massa
226.03 g/mol
Smeltpunt
Ongeveer 700 ºC. Deze omvang heeft niet precies kunnen worden bepaald.
Kookpunt
De radio kookt tussen 1100 en 1700 ºC. Deze grote marge van onnauwkeurigheid weerspiegelt opnieuw de complicaties van het manipuleren van zo'n onstabiel metaal.
Dikte
5.5 g/cm3
Fusiewarmte
8.5 kJ/mol
Verdampingswarmte
113 kJ/mol
Oxidatie toestand
De radio heeft een enkele +2 oxidatietoestand.
Elektronegativiteit
0.9. Deze waarde komt trouw overeen met het sterke elektropositieve karakter van de straal.
Ionisatie -energieën
Eerst: 509.3 kJ/mol
Ten tweede: 979 kJ/mol
Radioactiviteit
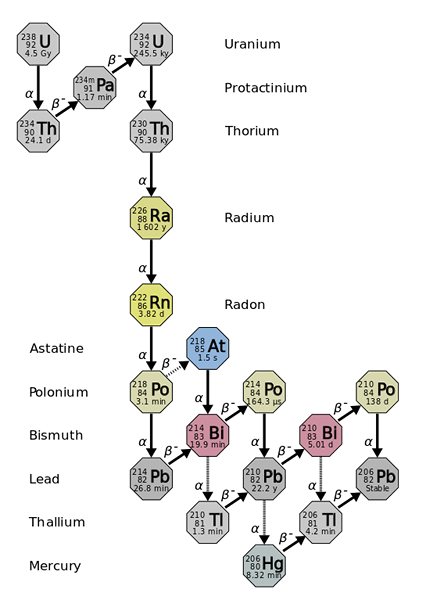 De straal komt voort uit de radioactieve dalingen van zwaardere en meer onstabiele elementen, zoals bij de uranium-238 isotoop. Bron: Gebruiker: Tosaka, CC door 3.0, via Wikimedia Commons
De straal komt voort uit de radioactieve dalingen van zwaardere en meer onstabiele elementen, zoals bij de uranium-238 isotoop. Bron: Gebruiker: Tosaka, CC door 3.0, via Wikimedia Commons De straal is ongeveer een miljoen keer meer radioactief dan uranium. Dit is vooral te wijten aan het feit dat er andere isotopen uit worden geproduceerd, zoals 222RN (superieure afbeelding), die op zijn beurt vervalt door α -deeltjes uit te zenden om te transformeren in de isotoop 218Po. Een radiomonster geeft daarom grote hoeveelheden α- en β -deeltjes uit-, evenals γ -stralen.
Een gram radio bijvoorbeeld lijdt 3.7 · 1010 Desintegraties per seconde, maatregel die diende om de CI -eenheid te definiëren, Curie genaamd. Deze energie is voldoende om een monster van 25 gram water 1 ° C per uur te verwarmen.
Als de vervalketen wordt waargenomen, is te zien dat de initiële isotoop, de 238U, u hebt een T1/2 van 4.5 giga -jaren (miljarden jaren); terwijl in plaats daarvan de 226RA heeft een T1/2 1600 jaar, die ook isotopen produceert met T1/2 van slechts enkele dagen, minuten en seconden.
De radioactiviteit van de radio en zijn verbindingen is ioniseert, dus fluorescerende stoffen, zelfs de omringende atomen, licht op in de nacht, en kunnen explosieve reacties veroorzaken. Deze eigenschap staat bekend als radioluminescentie.
Verbindingen en reactiviteit
Wanneer zouten of radioverbindingen in een lichter worden verwarmd, schieten ze een karmijnvlam af. Dergelijke vaste stoffen zijn meestal wit of kleurloos, maar ze zijn geel geverfd en uiteindelijk donker worden als gevolg van de radioactiviteit van radioatomen. Als ze bariumonzuiverheden hebben, kunnen ze roze tonen tonen.
Kan u van dienst zijn: dubbele substitutiereactieDe radiochemie lijkt erg op die van Bario, alsof ze twee onafscheidelijke broers zijn, Ra-Ba. Beide vormen dezelfde zouten, onoplosbaar in water, met het verschil dat die van de straal een beetje onoplosbaar is. Bijvoorbeeld radiosulfaat, satijn4, Het is meer onoplosbaar dan bariumsulfaat, Baso4; In feite is het het meest onoplosbare sulfaat ooit gekend: 2.1 mg ervan lost op slechts 1 liter water op.
Aan de andere kant, radiohydroxide, ra (oh)2, Het is de meest oplosbare en basis van alle hydroxiden van hun leeftijdsgenoten.
In oplossing, ra -kationen2+, In plaats van zich te gedragen als Lewis -zuren, zijn ze basic, omdat hun grote omvang het onmogelijk maakt voor de moleculen.
De chemische analogie tussen de radio en het barium keert terug naar dit metaal dat moeilijk te scheiden is, omdat de zouten coprecipiteren met die van de barium.
Radio gebruikt/applicaties
Lichtgevende horloges
 De lichtgevende en fosforescerende horloges waren zeer gewenst in de negentiende eeuw, vanwege hun visuele aantrekkelijkheid en voor het bevatten van de veelgeprezen radio in hun schilderijen. Bron: Weapon95, CC BY-SA 3.0, via Wikimedia Commons
De lichtgevende en fosforescerende horloges waren zeer gewenst in de negentiende eeuw, vanwege hun visuele aantrekkelijkheid en voor het bevatten van de veelgeprezen radio in hun schilderijen. Bron: Weapon95, CC BY-SA 3.0, via Wikimedia Commons Het meest populaire en controversiële gebruik van de straal moest worden gebruikt als een additief voor de schilderijen van de horloges. De atomen werden opgenomen in de pastei -formuleringen van zinksulfide, ZnS, die radioactieve emissies absorbeerden om een groen en fosforescerend licht af te geven. De verf werd aangebracht op de klokken (superieure afbeelding).
Het probleem van dit gebruik was in de continue radioactieve blootstelling die de gebruikers van deze horloges beïnvloedde; Of erger nog, voor de arbeiders die ze in de fabrieken hebben geschilderd.
In 1924 begonnen verschillende werknemers die in een verfindustrie werkten, later bekend als de Radio Girls (Radium Girls), te lijden aan botkanker, vervormingen van hun kaken en tandenverliezen, omdat ze de tip van je borstels moesten likken om te zijn in staat om radioactieve verf op klokken aan te brengen.
Dit, plus de onwetendheid van de straal, en de kleine ethiek van het niet opleggen van beschermingsmaatregelen die de veiligheid van werknemers hebben gegarandeerd, eindigden in een juridisch schandaal dat een revolutie teweegbracht.
Kan u van dienst zijn: HUREN HALOGENUROS: Eigenschappen, verkrijgen, voorbeeldenRadio -schilderijen werden niet meer vervaardigd in 1960; Hoewel er vandaag verschillende verzamelmonsters zijn die het op hun oppervlakken hebben.
Radithor
 Radithor -fles tentoongesteld in het National Museum of Nuclear Science and History, New Mexico. Bron: Sam Larussa uit de Verenigde Staten van Amerika, CC BY-SA 2.0, via Wikimedia Commons
Radithor -fles tentoongesteld in het National Museum of Nuclear Science and History, New Mexico. Bron: Sam Larussa uit de Verenigde Staten van Amerika, CC BY-SA 2.0, via Wikimedia Commons De Radithor was een van de vele farmaceutische en cosmetische producten die de radio -efficiëntie verkondigden om duizend en één ziek te vechten. Het bevatte een micrometrische radio -hoeveelheid, die, omdat het alle spijsverterings- en endocriene ziekten zou moeten genezen. In 1932, na de dood van Eden Byers, een van de meest fervente consumenten, verliet de Radithor echter de markt.
Radiotherapie
Niet alle radiogebruik was sensationeel, pseudowetenschappelijk en gewetenloos (of criminelen). Er waren ook echt gunstig voor de gezondheid, althans tot enige tijd. Radiozout, racl2 en Rab2, Ze worden gebruikt bij de behandeling van kanker, met name botkanker.
De isotoop 223RA, wanneer verward door calciumionen in het metabolisme, vernietigt uiteindelijk kankercellen die zich in het bot bevinden.
Veel van het therapeutische gebruik van de straal zijn echter vervangen door veiliger, economische en efficiënte isotopen, zoals de 60CO en 137CS.
Het verkrijgen van
De radio is een van de elementen waarvan de productie schaars is: ongeveer 100 gram per jaar wereldwijd. Ton van uraniumoranje, zoals de Pechblenda (of uraniniet) erts worden verwerkt volgens de Curie -methode, die bestaat uit het behandelen van monsters met natriumhydroxide, zoutzuur en natriumcarbonaat, zodat een mengsel van radio- en bariumsulfaten, satine, satine, satine, satine, satine, satine, satine4-Baso4.
Het satijnenmengsel4-Baso4 Het werd omgezet in hun respectieve chloriden, racl2-Bacl2, De kationen scheiden RA2+ door fractionele kristallisaties en uiteindelijk zuiveren van ionische chromatografietechnieken. De racl2 Het wordt verminderd door elektrolyse, of het reduceren met metaalaluminium tot 1200 ºC.
Isotopen
Alle radio -isotopen zijn radioactief. Vier van hen bestaan in de natuur als producten van het radioactieve verval van atomen van 232E, 235U en 238OF.
Deze vier isotopen zijn: 223Ra (T1/2= 11.4 dagen), 224Ra (T1/2= 3.64 dagen), 226Ra (T1/2= 1600 jaar) en 228RA (5.75 jaar). Uiteraard bestaan bijna alle radioatomen uit isotoopmengsels 226Ra en 228Ra, omdat anderen snel uiteenvallen.
Hij 226RA is de meest stabiele van alle isotopen van de radio, alle anderen zijn te onstabiel, met T1/2 Minder dan twee uur.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (vierde druk). MC Graw Hill.
- Wikipedia. (2020). Radium. Opgehaald uit: in.Wikipedia.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Radium. Hersteld van: Britannica.com
- Radioactiviteit. (S.F.)). Radium: de radioactieve kern die geschiedenis heeft gemaakt. Hersteld van: radioactiviteit.EU.com
- Cantrill, v. (2018). De realiteit van radium. Nature Chem 10, 898. doen.org/10.1038/S41557-018-0114-8
- Elsevier B.V. (2020). Radium. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- « Winderosiefactoren, typen, gevolgen, voorbeelden
- Italiaanse schiereiland Geografie, landen, flora, fauna, klimaat »

