Atomaire radio
- 2964
- 627
- Hugo Crooks
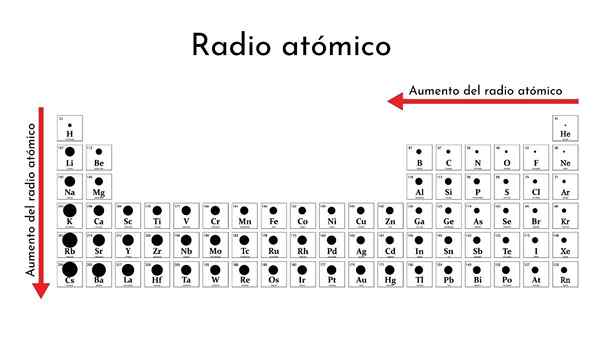
 Periodiek systeem van de elementen met atomaire radio's
Periodiek systeem van de elementen met atomaire radio's Wat is de atomaire radio?
Hij atomaire radio Het is een belangrijke parameter voor de periodieke eigenschappen van de elementen van het periodiek systeem. Het is direct gerelateerd aan de grootte van de atomen, omdat de grotere radio, groter of omvangrijk zijn. Evenzo is het gerelateerd aan de elektronische kenmerken van hetzelfde.
Terwijl een atoom meer elektronen heeft, hoe groter zijn atoomgrootte en radio. Beide worden gedefinieerd door de elektronen van de Valencia -laag, omdat op afstanden buiten hun banen de kans op het vinden van een elektron nadert naar nul. Het tegenovergestelde komt voor in de buurt van de kern: de kans op het vinden van een elektron is verhoogd.
 Wattenballetpakket. De manier waarop ze zijn verdicht, definieert hun grootte en radio's, op dezelfde manier die gebeurt met atomen
Wattenballetpakket. De manier waarop ze zijn verdicht, definieert hun grootte en radio's, op dezelfde manier die gebeurt met atomen De bovenste afbeelding vertegenwoordigt een verpakking van wattenbollen. Merk op dat elk is omgeven door zes buren, niet een andere mogelijke of lagere rij tellen. De manier waarop wattenbollen worden verdicht, zal hun maten en daarom hun radio's definiëren; Zoals bij atomen.
De elementen volgens hun chemische aard interageren op de een of andere manier met hun eigen atomen. Daarom varieert de grootte van de atoomradius afhankelijk van het type binding aanwezig en met de vaste verpakking van zijn atomen.
Hoe wordt de atomaire straal gemeten?
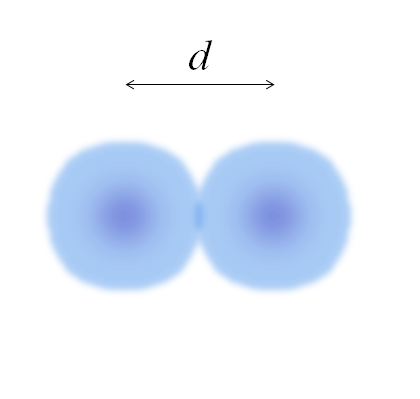 Afbeelding van twee atomen, waarvan de randen niet volledig zijn gedefinieerd. Bron: Gabriel Bolívar
Afbeelding van twee atomen, waarvan de randen niet volledig zijn gedefinieerd. Bron: Gabriel Bolívar In de vorige afbeelding kan het eenvoudig zijn. De sfeer van een atoom is echter niet volledig gedefinieerd. Omdat? Omdat elektronen circuleren en vervagen in betonnen regio's van de ruimte: orbitalen.
Daarom kan het atoom worden beschouwd als een bol met impalpabele randen, wat het onmogelijk is om met zekerheid te zeggen waar ze eindigen. Bijvoorbeeld, in het superieure beeld ziet het gebied van het centrum, dicht bij de kern, er een intensere kleur uit, terwijl de randen wazig zijn.
Kan u van dienst zijn: solvatieHet beeld vertegenwoordigt een diatomee molecuul en2 (Zoals de CL2, H2, OF2, enz.)). Ervan uitgaande dat atomen bolvormige lichamen zijn, als de afstand is bepaald D Dat scheidt beide kernen in de covalente link, het zou dan voldoende zijn om het in twee helften te verdelen (D/2) om de atomaire straal te verkrijgen; Meer precies, de covalente straal van E voor E2.
Wat als E geen covalente bindingen met zichzelf vormde, maar het was een metalen element? Dus D Het zou worden aangegeven door het aantal buren rond E in hun metalen structuur; dat wil zeggen door het coördinatienummer (n.C) van het atoom in de verpakking (onthoud de wattenbolletjes van de afbeelding).
Bepaling van de internucleaire afstand
Om te bepalen D, die de internucleaire afstand is voor twee atomen in een molecuul of verpakking, zijn fysieke analysetechnieken vereist.
Een van de meest gebruikte is X -RAY -diffractie. Het straalt een lichtstraal door een glas en het diffractiepatroon als gevolg van de interacties tussen elektronen en elektromagnetische straling wordt bestudeerd.
Afhankelijk van de verpakking kunnen verschillende diffractiepatronen worden verkregen en daarom andere waarden van D.
Als de atomen "strak" zijn in het kristallijne netwerk, presenteren ze verschillende waarden van D vergeleken met degenen die zouden hebben als ze "comfortabel" waren.
Evenzo kunnen deze internucleaire afstanden variëren van waarden, dus de atomaire straal bestaat eigenlijk uit een gemiddelde waarde van dergelijke metingen.
Hoe verhoudt de atomaire straal en coördinatienummer zich?? V. Goldschmidt vestigde een relatie tussen de twee, waarin voor een n.C van 12, de relatieve waarde is 1; van 0.97 voor verpakkingen waar het atoom n heeft.C gelijk aan 8; van 0.96, voor een n.C gelijk aan 6; en 0.88 voor een n.C van 4.
Kan u van dienst zijn: natriumpermanganaat (NAMNO4): eigenschappen, risico'sEenheden
Van de waarden voor n.C gelijk aan 12, veel van de tabellen zijn gebouwd waar de atomaire radio's van alle elementen van het periodiek systeem worden vergeleken.
Omdat niet alle elementen dergelijke compacte structuren vormen (n.C minder dan 12), de V -verhouding wordt gebruikt. Goldschmidt om hun atomaire radio's te berekenen en ze uit te drukken voor dezelfde verpakking. Op deze manier zijn de metingen van atomaire radio's gestandaardiseerd.
Maar in welke eenheden worden uitgedrukt in? Gezien D Het is van een zeer kleine omvang, de eenheden van de angstrom Å (10 ∙ 10-10m) of ook veel gebruikt, de picometer (10 ∙ 10-12M).
Hoe verander je in het periodieke tabel?
Over een periode
De atomaire radio's bepaald voor metaalelementen worden metaalradio's genoemd, terwijl voor die niet -metalen elementen covalente radio's (zoals fosforus, p4, of zwavel, s8)). Tussen beide soorten radio's is er echter een meer prominent onderscheid dan de naam.
Van links naar rechts in dezelfde periode voegt de kern protonen en elektronen toe, maar de laatste zijn beperkt tot hetzelfde energieniveau (hoofdkwantumnummer).
Als gevolg hiervan oefent de kern een groeiende effectieve nucleaire belasting uit op valentie -elektronen, die de atoomradius contracteert.
Op deze manier hebben niet -metalen elementen in dezelfde periode de neiging om kleinere atoom (covalente) radio's te hebben.
Afdalen door een groep
Bij het afdalen door een groep worden nieuwe energieniveaus ingeschakeld, waardoor elektronen meer ruimte kunnen hebben. Aldus bedekt de elektronische wolk grotere afstanden, zijn wazige periferie eindigt meer van de kern en daarom breidt de atomaire straal uit.
Kan u van dienst zijn: Hydroxyl GroupLantanide samentrekking
De elektronen van de binnenste laag helpen de effectieve nucleaire belasting op de valentie -elektronen te schijnen. Wanneer de orbitalen die de interne lagen vormen, veel "holtes" (knooppunten) hebben, zoals bij de f -orbitalen, samentrekt de kern sterk de atoomradius door het slechte schildeffect daarvan.
Dit feit wordt bewezen in de lantanide -contractie in periode 6 van het periodiek systeem. Uit de HF is er een aanzienlijke samentrekking van het atomaire straalproduct van de orbitalen F, die worden "gevuld" als het blok F: die van de lantanoides en actinoïden worden afgelegd.
Een soortgelijk effect kan ook worden waargenomen met de elementen van blok P uit periode 4. Dit keer product van het zwakke afschermingseffect van de D -orbitalen die worden gevuld door de periodes van overgangsmetalen te reizen.
Atomische radio's voorbeelden
Voor periode 2 van het periodiek systeem zijn de atomaire radio's van zijn elementen:
-Li: 257 uur
-Be: 232 uur
-B: 208 uur
-C: 197 uur
-N: 19.00 uur
-O: 18.00 uur
-F: 18.00 uur
Merk op dat het lithiummetaal de grootste atoomradius (257 pm) heeft, terwijl fluor, gelegen aan de rechterkant van de periode, de kleinste van allemaal is (18.00 uur). De atomaire straal daalt in dezelfde periode van links naar rechts af en de lijstwaarden laten het zien.
Lithium, door metaalbindingen te vormen, is de straal metallic; en fluoride, als vorm covalente bindingen (f-f), de straal is covalent.
Wat als u atomaire radio's wilt uitdrukken in angstrom -eenheden? Het zal voldoende zijn om ze door 100 te verdelen: (257/100) = 2.57Å. En zo verder met de rest van de waarden.
Referenties
- Chemie 301. Atomic radii. Hersteld van: CH301.cm.Utexas.Edu
- CK-12 Foundation (2016). Atoomstraal. Hersteld van: chem.Librhetxts.borg
- Trends in atomaire radii. Genomen van: Intro.Chem.Okstate.Edu
- Clackamas Community College (2002). Atoommaat. Opgehaald van: DL.clackamas.Edu
- Clark J. (2012). Atoom- en ionische straal. Hersteld van: chemguide.co.Uk
- Shiver & Atkins. (2008). Anorganic Chemistry (vierde editie, p. 23, 24, 80, 169). MC Graw Hill.

