Wat is bandtheorie?
- 1742
- 213
- Ernesto McKenzie
Wat is bandtheorie?
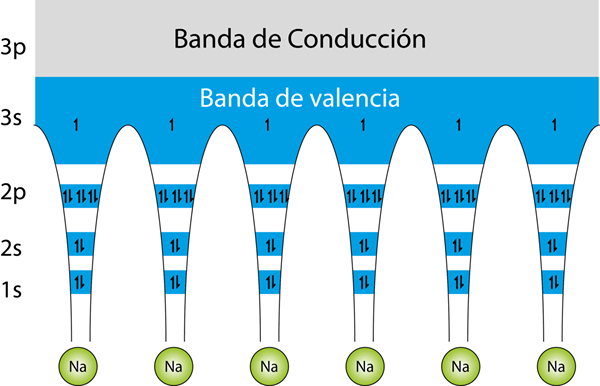
 Structuur van energiebanden voor een metallisch natriumglas. De pijlen vertegenwoordigen de elektronen. Elk natriumatoom heeft 11 elektronen. 10 van hen zijn in interne orbitalen en het enige elektron in Valencia bevindt zich in de Valencia -band, terwijl de rijband leeg is
Structuur van energiebanden voor een metallisch natriumglas. De pijlen vertegenwoordigen de elektronen. Elk natriumatoom heeft 11 elektronen. 10 van hen zijn in interne orbitalen en het enige elektron in Valencia bevindt zich in de Valencia -band, terwijl de rijband leeg is De Bandtheorie Het wordt gebruikt om uit te leggen hoe metaalatomen aan elkaar binden en waarom ze zulke goede elektriciteitsgeleiders zijn, terwijl andere materialen isolerend zijn. Met andere woorden, Het is een theorie die uitlegt hoe de metalen link werkt.
In elk stuk metaal, zoals in een nagel of in een stuk koperen kabel, bijvoorbeeld, zijn de atomen heel dichtbij en heel dicht bij elkaar.
Volgens de theorie van banden, vanwege deze nabijheid, zijn de atomaire orbitalen (de plaats waar hun elektronen worden gevonden) gemengd om een enkele gigantische baan te vormen die meer lijkt op een "band" dan een orbitaal dan een orbitaal.
Wanneer dit gebeurt, worden er in principe twee banden gevormd die de Valencia -band en de rijband zijn (daarom het meervoud in bandtheorie).
De Valencia Band
Deze band wordt gevormd door de combinatie van de Valencia -orbitalen van elk atoom. Dit zijn de laatste orbitalen die worden bezet door elektronen in elk individueel atoom.
De Valencia -band is de plaats waar de elektronen van een metaal zich bevinden wanneer de atomen ontspannen zijn. Dat wil zeggen, wanneer ze niet zijn enthousiast over de toepassing van een elektrisch potentieel, bijvoorbeeld.
De rijband
De drijfband wordt gevormd door de combinatie van de eerste niet -bezette of lege orbitalen van elk atoom. Meestal wordt de drijfband gevormd door P- of D -orbitalen die elkaar overlappen. Dit geeft aanleiding tot een band die lijkt op een snelweg die door de ruimte gaat die boven en onder de lagen atomen is.
Kan u van dienst zijn: zwakke honkenWanneer een elektron de rijlaag binnengaat, wordt gezegd dat het "gedemocaliseerd" is, omdat het vrij van de ene plaats naar de andere kan worden verplaatst en zich niet rond een bepaald atoom bevindt.
Een nuttige analogie
Om beter te begrijpen wat de structuur van de banden die in metalen worden gevormd, is het handig om wat analogieën te gebruiken.
We kunnen ons een vaste stof van elke stof voorstellen alsof het een gebouw is waarin elk appartement een atoom vertegenwoordigt, en in elk appartement kunnen de kamers met hun respectieve bed worden gezien als de orbitalen waar de elektronen verblijven.
 Een vaste stof kan worden voorgesteld als een appartementengebouw waarin elk appartement een atoom is, en de elektronen die erin worden gevonden, kunnen van het ene appartement naar het andere gaan
Een vaste stof kan worden voorgesteld als een appartementengebouw waarin elk appartement een atoom is, en de elektronen die erin worden gevonden, kunnen van het ene appartement naar het andere gaan In een Niet -geleidingsmateriaal, Alle elektronen bevinden zich rond hun respectieve atoom. Dit is hetzelfde als zeggen dat elk appartement gesloten is en de elektronen niet vrij zijn om van het ene "appartement" naar het andere te gaan (dat wil zeggen van het ene atoom naar het andere), simpelweg omdat veel energie nodig is om alle deuren te openen En ga uit.
Aan de andere kant, in een Geleidend materiaal Als een metaal zijn de dingen heel anders. De atomen zijn zo dicht bij elkaar, dat hun orbitalen (de kamers) met elkaar samenkomen om een enkele gigantische baan te vormen. Dit zou hetzelfde zijn als het kloppen van alle muren op een vloer en het maken van een enkele gemeenschappelijke kamer vol bedden.
Deze gigantische kamer zou het equivalent zijn van de "Valencia -band”, Waarin de elektronen zich in hun respectieve bedden bevinden, maar ze zijn allemaal in dezelfde kamer. Naast het vormen van deze kamer, kunt u ernaast een brede hal krijgen die elektronen kunnen gebruiken om van de ene plaats naar de andere te gaan.
Het kan u van dienst zijn: Mercurychloride (ii): structuur, eigenschappen, verkrijgen, gebruikDeze grote gang vertegenwoordigt wat we noemen de "rijband". Wanneer de elektronen in de hal zijn, bevinden ze zich niet in een bepaald atoom (ze worden gedemoceerd) en kunnen zonder enig probleem vrij van de ene plaats naar de andere worden verplaatst.
Elektrische geleiding en bandtheorie
Zodra de vorming van Valencia en rijbanden is begrepen, is het gemakkelijk om te begrijpen waarom sommige materialen goede bestuurders zijn en waarom anderen dat niet doen.
De sleutel tot elektrische geleiding is hoe moeilijk het is om de elektronen in de Valencia -band naar de drijfband te verplaatsen of opwinden.
Dit hangt alleen af van hoe dicht de energieniveaus van beide banden zijn. Afhankelijk van dit energieverschil kunnen drie soorten materialen worden onderscheiden:
Geleidingsmaterialen
Geleidende materialen, zoals metalen, worden gekenmerkt door te hebben Valencia en rijbanden praktisch samen En bijna zonder energieverschil tussen de een en de ander.
Dit betekent dat de minimale opwinding.
Volgens de bovengenoemde analogie zou dit hetzelfde zijn als zeggen dat er bijna niets is om de gemeenschappelijke kamer (de Valencia -band) uit de hal (de rijband) te scheiden. Om deze reden kan een elektron gemakkelijk de hal bereiken, zonder enige deur die de doorgang voorkomt.
 Een kamer zonder muren en met veel bedden, is een afbeelding vergelijkbaar met de Valencia -band die in een metal wordt gevormd. Elektronen kunnen gemakkelijk van de ene plaats naar de andere door de gangen gaan, die gelijkwaardig zijn aan de rijband
Een kamer zonder muren en met veel bedden, is een afbeelding vergelijkbaar met de Valencia -band die in een metal wordt gevormd. Elektronen kunnen gemakkelijk van de ene plaats naar de andere door de gangen gaan, die gelijkwaardig zijn aan de rijband Niet -geleider- of isolerende materialen
Wat gebeurt er met materialen zoals kunststoffen of hout die geen elektriciteit leiden? In gevallen van isolatiematerialen hebben de Valencia -band en de drijfband zeer grote energieverschillen.
Kan u van dienst zijn: calorimeterDit betekent dat, om een elektron van de Valencia -laag naar het rijden te nemen.
In de gebouwanalogie kan dit worden gezien als elektronen moeten door vele gesloten deuren gaan om hun kamers naar de gang te verlaten. Ze zitten letterlijk gevangen in hun respectieve atomen.
Halfgeleider materialen
Tussen de geleidende en niet -geleidermaterialen kunnen we een derde groep materialen vinden die halfgeleiders worden genoemd.
In deze materialen staan de Valencia- en rijbanden niet naast elkaar zoals in de geleidende materialen, dus er is een energiekloof die elektronen moeten overwinnen om naar de rijband te kunnen gaan. Deze kloof of energieverschil is echter niet zo hoog als in het geval van niet -geleidingsmaterialen.
De energiekloof tussen de twee banden laat deze materialen niet toe om elektriciteit bij lage temperaturen aan te drijven. Wanneer de temperatuur echter wordt verhoogd, is de energie van de trillingen van de atomen voldoende om sommige elektronen op de rijband te prikkelen, zodat het materiaal de elektriciteit kan leiden.
Omdat deze materialen soms isolerend zijn en soms geleiders zijn, worden ze halfgeleidermaterialen genoemd. Enkele voorbeelden van dit type materialen zijn silicium, gallium en selenium.

